题目内容
10.短周期元素A、B、C、D的原子序数依次增大,原子半径rC>rD>rB>rA.B原子最外层电子数是其内层电子总数的3倍,D原子的核电荷数等于A、C原子核电荷数之和,A与C同主族.下列说法正确的是( )| A. | B的单质不存在同素异形体 | |
| B. | 单质D着火时,可用二氧化碳灭火器灭火 | |
| C. | 化合物A2B2与C2B2均只有氧化性 | |
| D. | A、B、C组成的化合物,25℃时若溶液浓度为0.1mol/L,则由水电离出的OH-为10-13mol/L |
分析 短周期元素A、B、C、D的原子序数依次增大,原子半径rC>rD>rB>rA.B原子最外层电子数是其内层电子总数的3倍,则B为O元素;A与C同主族,D原子的核电荷数等于A、C原子核电荷数之和,则C、D同在第三周期,由于A的半径小于O的半径,所以A只能为H或F,若A为H、C为Na,则D为Mg,若A为F、C为Cl,则D为Fe,不符合,
综上可知,A为H,B为O,C为Na,D为Mg,然后结合元素化合物性质及元素周期律来解答.
解答 解:短周期元素A、B、C、D的原子序数依次增大,原子半径rC>rD>rB>rA.B原子最外层电子数是其内层电子总数的3倍,则B为O元素;A与C同主族,D原子的核电荷数等于A、C原子核电荷数之和,则C、D同在第三周期,由于A的半径小于O的半径,所以A只能为H或F,若A为H、C为Na,则D为Mg,若A为F、C为Cl,则D为Fe,不符合,综上可知,A为H,B为O,C为Na,D为Mg,
A.B为O,氧元素的单质有氧气和臭氧,存在同素异形体,故A错误;
B.D为Mg,能与二氧化碳反应,所以单质Mg着火时,不可用二氧化碳灭火器灭火,故B错误;
C.化合物H2O2与Na2O2中氧元素的化合价为-1价,处于中间价态,既有还原性又有氧化性,故C错误;
D.A、B、C组成的化合物NaOH溶液,25℃时若溶液浓度为0.1mol/L,则溶液中氢离子浓度为10-13mol/L,该氢离子由水电离,则由水电离出的OH-也是10-13mol/L,故D正确.
故选D.
点评 本题考查原子结构与元素周期律知识,题目难度中等,本题注意根据离子的电子层结构判断元素在周期表中的位置,结合元素周期律的递变规律进行判断.

练习册系列答案
相关题目
18.化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( )
| A. | “地沟油”可以生产“生物燃料”,生物燃料本质上能量来源于太阳能 | |
| B. | 消除水体中的HgCl2污染可利用微生物使其转化为有机汞CH3HgCl | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,但可以加强胃肠蠕动,有助于消化,因此纤维素是人类的营养食物 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是经提纯的二氧化硅 |
15.25℃时,有关弱酸的电离常数如下:
下列说法中正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | HCN与Na2S溶液一定不能发生反应 | |
| D. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
15.阿司匹林也叫乙酰水杨酸,是一种历史悠久的解热镇痛药,诞生于1899年3月6日.用于治感冒、缺血性心脏病、心绞痛、心肺梗塞、脑血栓形成,也可提高植物出芽率,其结构如下,下列说法不正确的是( )

| A. | 阿司匹林的分子式是:C9H8O4 | |
| B. | 阿司匹林可以通过邻羟基苯甲酸与乙酸酯化反应制备,乙酸的用量应过量,可以提高邻羟基苯甲酸的转化率,同时也起到了溶剂的作用 | |
| C. | 原子经济性反应指原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,则阿司匹林制备符合原子经济性 | |
| D. | 阿司匹林分子中所有碳原子可以共平面 |
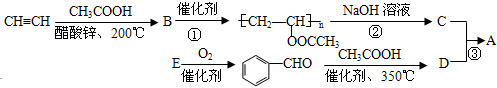
 ;反应类型是取代反应.
;反应类型是取代反应. .
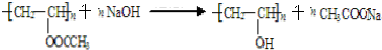
.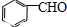 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是 .
.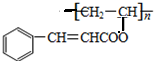 ,关于A的性质下列说法正确的是acd(填字母).
,关于A的性质下列说法正确的是acd(填字母).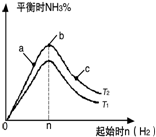 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
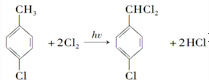 ;该反应的类型为取代反应.
;该反应的类型为取代反应. .
.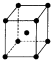 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: