题目内容
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
【答案】 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 1s22s22p63s23p63d104s1或 3d104s1 面心立方最密堆积 O N 正四面体 sp3 高于 因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点 CuCl 
【解析】(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-; 故答案为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(2)铜是29号元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,铜单质晶体中的原子堆积模型属于面心立方最密堆积,故答案为:1s22s22p63s23p63d104s1;面心立方最密堆积;
(3)上述深蓝色晶体所含的非金属元素有N、H、O、S,其中O元素的非金属性最强,电负性最大,N的2p为半充满状态,较为稳定,第一电离能最大。[Cu(NH3)4]2+形成4个配位键,具有对称的空间构型,中心原子的杂化方式为sp3,空间结构为正四面体,故答案为:O;N;正四面体;sp3;
(4)氨分子间能够形成氢键,沸点高于膦(PH3),故答案为:高于;因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点。
(5)晶胞中Cu位于顶点、面心,晶胞中Cu原子为8×![]() +6×
+6×![]() =4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×
=4,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;1mol晶胞的质量为4×![]() g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×
g,1mol晶胞的体积为a3 cm3,该晶体的密度为ρg·cm-3,因此a3 cm3×ρg·cm-3=4×![]() g,解得a=
g,解得a= cm=
cm= ×107 nm,故答案为:CuCl;
×107 nm,故答案为:CuCl;  ×107。
×107。
【题型】填空题
【结束】
12
【题目】有机物J是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:

已知:
回答下列问题:
(1)A→B的反应类型为_______________。C中的官能团名称为_____________________。
(2)D生成E的化学方程式为__________________________________。
(3)J的结构简式是_____________________。在一定条件下,H 自身缩聚生成高分子化合物的化学方程式为_______________________________________。
(4) 根据C![]()
![]() X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
X,x的分子式为_____________________。X有多种同分异构体,其中满足下列条件的同分异构体共有___________种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以乙烯和甲苯为原料,合成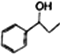 的路线流程图(其它试剂自选):__________________________________。
的路线流程图(其它试剂自选):__________________________________。
【答案】 取代反应 醛基、溴原子 


![]() 4
4 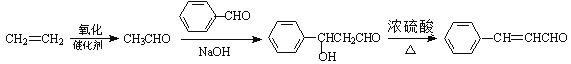
【解析】试题分析: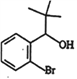
![]() H,根据
H,根据 可知H是
可知H是
,H脱水生成J,J属于酯类,除苯环外还含有一个五元环,所以J是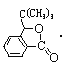 ;根据
;根据 中溴原子的位置,
中溴原子的位置, 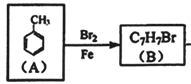 ,则B是
,则B是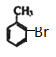 、C是
、C是![]() ;E是
;E是![]() 、F是
、F是![]() 。
。
解析:根据以上分析,(1)![]() 与液溴反应生成
与液溴反应生成 的反应类型为取代反应。
的反应类型为取代反应。![]() 中的官能团名称为醛基、溴原子。
中的官能团名称为醛基、溴原子。
(2)![]() 与HBr发生加成反应生成
与HBr发生加成反应生成![]() 的化学方程式为
的化学方程式为 ;
;
(3)J的结构简式是 ;在一定条件下,H是
;在一定条件下,H是 ,自身缩聚生成高分子化合物的化学方程式为
,自身缩聚生成高分子化合物的化学方程式为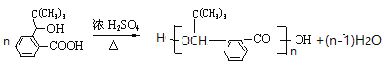 ;
;
(4)根据![]()
![]() X,x是
X,x是 ,分子式为
,分子式为![]() 。X有多种同分异构体,其中A.除苯环外无其他环,且无-O-O-键; B.能与FeCl3溶液发生显色反应,说明含有酚羟基; C.苯环上一氯代物只有两种,满足条件的同分异构体共有
。X有多种同分异构体,其中A.除苯环外无其他环,且无-O-O-键; B.能与FeCl3溶液发生显色反应,说明含有酚羟基; C.苯环上一氯代物只有两种,满足条件的同分异构体共有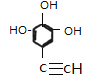 、
、 、
、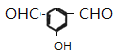 、
、![]() 共4种。
共4种。
(5)根据题中信息,甲苯![]()
![]()
![]() ;乙烯与溴化氢发生加成反应生成溴乙烷,溴乙烷在
;乙烯与溴化氢发生加成反应生成溴乙烷,溴乙烷在![]() 条件下生成
条件下生成![]() ,
,![]() 与
与![]() 反应生成
反应生成 ;合成路线流程图:
;合成路线流程图: ;
;


