题目内容
20.一氧化碳、甲醛、二氧化硫均有毒,均是常见的大气污染物.(1)人们常用催化剂来选择反应进行的方向,如图1为一定条件下1 molCH3OH与O2发生反应时,生成CO或CO2或HCHO的能量变化[反应物O2(g)和生成物H2O(g)已略去].
①在有催化剂的作用下,CH3OH与O2反应的主要产物是HCHO(填“CO”“CO2”或“HCHO”).
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H=-470KJ•mol-1.

(2)煤炭中的硫主要以黄铁矿的形式存在,用氢气脱出黄铁矿中硫的相关反应见下表,其相关反应的平衡常数的对数值与温度的关系如图2.
| 相关反应 | 反应热 | 平衡常数K |
| ①FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| ②$\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$FeS(s)+H2S(g) | △H2 | K2 |
| ③FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(任填一种).
③1000K时,向2L恒容密闭容器中充入一定量的H2(g)和FeS2(g),只发生反应①,达到平衡时,H2的转化率为99%.
(3)用细菌冶炼铜时,当黄铜矿中伴有黄铁矿时,可明显提高浸取速率,其原理如图3.
①冶炼过程中,正极周围溶液的pH增大(填“增大”“减小”或“不变”).
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
分析 (1)①使用催化剂可以降低反应的活化能,活化能越低,普通分子越容易转化成活化分子,反应越容易,反应速率越快;
②根据图表可知2HCHO(g)+O2(g)═2CO(g)+2H2O(g)中反应物能量高,生成物能量低,该反应为放热反应,然后依据图中给出数据解答;
(2)①由图可知,温度越高,K值越大,说明此反应为吸热反应;
②由图可知:温度升高,反应向正反应方向移动,硫的脱除率越高;
③根据图象可知,1000K时,平衡常数的对数lgK1=2,则K1=100,设加入的氢气的物质的量为x,转化率为y,则得到平衡时氢气的物质的量为x(1-y),根据反应①及平衡常数表达式列式计算出y即可;
(3)①用细菌冶铜时,正极为氧气放电,氧气得到电子,结合溶液中的H离子生成水;
②负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质.
解答 解:(1)①根据图象可以看出转化成甲醛时活化能最低,使用催化剂时主要产物为HCHO;
故答案为:HCHO;
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)该反应为放热反应,△H=-2(676-158-283)KJ•mol-1=-470KJ•mol-1;
故答案为:-470KJ•mol-1;
(2)①由图可知,温度越高,K值越大,说明此反应为吸热反应,故△H>0,
故答案为:>;
②由图可知:此反应为吸热反应,故升高温度,可以使反应向正向移动,即硫的脱除率越高,
故答案为:升高温度;
③根据图象可知,1000K时,平衡常数的对数lgK1=2,则K1=100,
设加入的氢气的物质的量为x,转化率为y,则得到平衡时氢气的物质的量为x(1-y),
根据反应FeS2(s)+H2(g)?FeS(s)+H2S(g)可知,K1=$\frac{x}{x(1-y)}$=100,解得:y=0.99,即:氢气的转化率为99%,
故答案为:99%;
(3)①正极为氧气放电,氧气得到电子,结合溶液中的H+离子生成水,故溶液中氢离子浓度减小,pH值增大,
故答案为:增大;
②负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质,电极反应方程式为:CuFeS2-4e-=Cu2++Fe2++2S,
故答案为:CuFeS2-4e-=Cu2++Fe2++2S.
点评 本题主要考查的是化学平衡常数的有关计算、热化学方程式的计算,题目难度中等,注意掌握热化学方程式的书写原则及原电池工作原理,明确化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 铁晶须是合金 | B. | 铁晶须不与酸反应 | ||
| C. | 铁晶须可被磁铁吸引 | D. | 铁晶须易溶于水 |
| A. | 在鸡蛋清溶液中加入稀的或饱和的NaCl溶液,其作用是-样的 | |
| B. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 | |
| C. | 在一定条件下,苯与浓溴水、浓硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| D. | 开发核能、太阳能等新能源.推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排. |
| A. | 13.6g | B. | 10.2g | C. | 6.8g | D. | 1.7g |
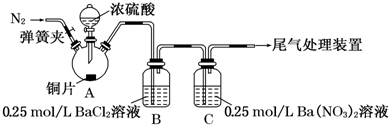
实验操作和现象:
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C 中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4(化学式).
(3)C溶液中发生的离子方程式为3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气
乙在A、B间增加洗气瓶D,D中盛放的试剂是浓硫酸或饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
| A. | 需用托盘天平称取NaOH固体19.6g | |
| B. | 氢氧化钠固体溶解之后迅速转移至容量瓶中,以防变质 | |
| C. | 加蒸馏水至离刻度线1~2cm时改用胶头滴管定容 | |
| D. | 容量瓶使用前没有干燥会使所配溶液浓度偏低 |
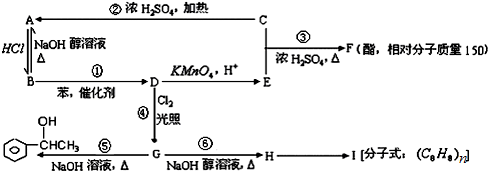
 ,
,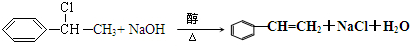 .写出H→I的反应方程式
.写出H→I的反应方程式 .
.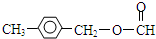 或
或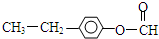 .
. .
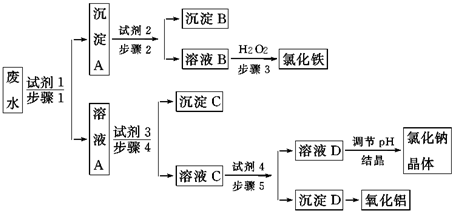
.
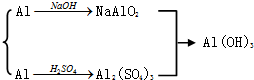
 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )