题目内容
10.已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢.根据以下转化关系(生成物中所有无机物均已略去),回答下列问题: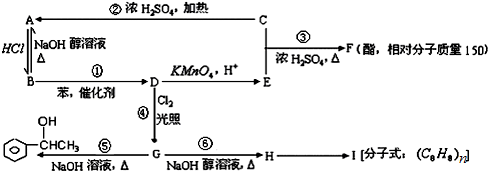
(1)H,E中所含官能团的名称分别是碳碳双键、羧基,D的结构简式为
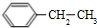 ,
,(2)①②③④⑤⑥反应中属于消去反应的是②⑥.
(3)写出⑥的反应方程式
 .写出H→I的反应方程式
.写出H→I的反应方程式 .
.(4)写出一种符合下列要求的F的同分异构体的结构简式;
①F的同分异构体中属于酯类,能发生银镜反应,且苯环上的一氯取代物只有两种:
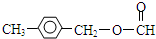 或
或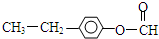 .
.②F的同分异构体中属于醇类,能发生银镜反应,且苯环上的一氯取代物只有两种:
 .
.
分析 D与Cl2在光照条件下生成的G,G为卤代烃,G与NaOH溶液加热发生取代反应生成 ,故G为
,故G为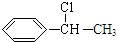 ,G发生消去反应生成H为
,G发生消去反应生成H为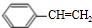 ,H发生加聚反应生成高聚物I为
,H发生加聚反应生成高聚物I为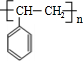 .逆推可知D为
.逆推可知D为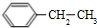 ,D发生氧化反应生成E为
,D发生氧化反应生成E为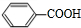 .由A与B的相互转化可知B为卤代烃,而B与苯发生反应生成D,故B为CH3CH2Cl,则A为CH2=CH2,C为CH3CH2OH,E与C发生酯化反应生成F为
.由A与B的相互转化可知B为卤代烃,而B与苯发生反应生成D,故B为CH3CH2Cl,则A为CH2=CH2,C为CH3CH2OH,E与C发生酯化反应生成F为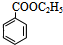 ,据此解答.
,据此解答.
解答 解:D与Cl2在光照条件下生成的G,G为卤代烃,G与NaOH溶液加热发生取代反应生成 ,故G为
,故G为 ,G发生消去反应生成H为
,G发生消去反应生成H为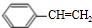 ,H发生加聚反应生成高聚物I为
,H发生加聚反应生成高聚物I为 .逆推可知D为
.逆推可知D为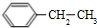 ,D发生氧化反应生成E为
,D发生氧化反应生成E为 .由A与B的相互转化可知B为卤代烃,而B与苯发生反应生成D,故B为CH3CH2Cl,则A为CH2=CH2,C为CH3CH2OH,E与C发生酯化反应生成F为
.由A与B的相互转化可知B为卤代烃,而B与苯发生反应生成D,故B为CH3CH2Cl,则A为CH2=CH2,C为CH3CH2OH,E与C发生酯化反应生成F为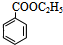 ,
,
(1)由上述分析可知,H为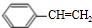 ,含有官能团为碳碳双键,E为
,含有官能团为碳碳双键,E为 ,含有官能团为羧基,D的结构简式为
,含有官能团为羧基,D的结构简式为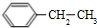 ;
;
故答案为:碳碳双键;羧基;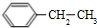 ;
;
(2)①为取代反应,②为消去反应,③为酯化反应或取代反应,④为取代反应,⑤为取代反应,⑥为消去反应,所以属于消去反应的是②⑥,
故答案为:②⑥;
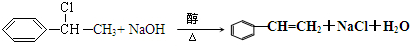
(3)反应⑥是G与NaOH醇溶液加热发生消去反应,化学方程式为:
H发生加聚反应生成I,化学方程式为: ,
,
故答案为: ;
; ;
;
(4)①F的同分异构体中属于酯类,能发生银镜反应,且苯环上的一氯取代物只有两种,说明该物质为甲酸酯,可能的结构为: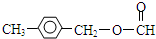 或
或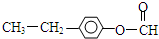 ,
,
故答案为: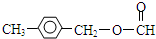 或
或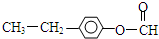 ;
;
②F的同分异构体中属于醇类,能发生银镜反应,且苯环上的一氯取代物只有两种,说明该物质含有羟基和醛基,苯环上的两个支链位于对位,可能的结构为: ,
,
故答案为: .
.
点评 本题考查有机物推断同分异构体、反应类型、化学方程式的书写、元素的检验,注意根据G的反应产物利用逆推法进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

| A. | 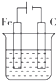 | B. | 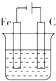 | C. | 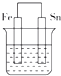 | D. | 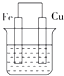 |
| A. | 物质的量是七个基本物理量之一,符号为mol | |
| B. | 摩尔质量在数值上等于该物质的相对分子质量或相对相对原子质量 | |
| C. | 标准状况下,气体的摩尔体积为22.4L | |
| D. | 11.7克氯化钠溶于1000毫升水中,所得溶质的物质的量浓度为0.2mol•L-1 |
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的原子数为0.4NA | |
| B. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| C. | 含2mol H2SO4的浓硫酸与足量铜粉完全反应,生成气体分子的数目为2NA | |
| D. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA |
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
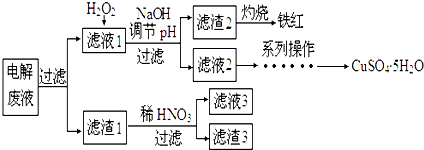
(1)电解精炼铜时粗铜板作阳极,阴极电极反应式为Cu2++2e-═Cu.电解过程中,电解液中c(Cu2+)变小(填变大、变小、不变).对电解废液进行如下处理
已知:①某些金属离子形成氢氧化物沉淀的pH如表
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |
(2)滤液l中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加NaOH溶液调节溶液pH的范围是3.2≤pH<4.7.
(4)滤渣1跟稀HNO3反应的化学方程式是3Ag+4HNO3═3AgNO3+NO↑+2H2O.
| A. | 在BF3、NaCl3分子中,所有原子都满足8电子稳定机构 | |
| B. | P4和CH4空间结构相同,其具有的化学键类型也完全相同 | |
| C. | Cl-的结构示意图可表示为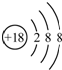 | |
| D. | COS的电子式可表示为 |
(1)人们常用催化剂来选择反应进行的方向,如图1为一定条件下1 molCH3OH与O2发生反应时,生成CO或CO2或HCHO的能量变化[反应物O2(g)和生成物H2O(g)已略去].
①在有催化剂的作用下,CH3OH与O2反应的主要产物是HCHO(填“CO”“CO2”或“HCHO”).
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H=-470KJ•mol-1.

(2)煤炭中的硫主要以黄铁矿的形式存在,用氢气脱出黄铁矿中硫的相关反应见下表,其相关反应的平衡常数的对数值与温度的关系如图2.
| 相关反应 | 反应热 | 平衡常数K |
| ①FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| ②$\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$FeS(s)+H2S(g) | △H2 | K2 |
| ③FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(任填一种).
③1000K时,向2L恒容密闭容器中充入一定量的H2(g)和FeS2(g),只发生反应①,达到平衡时,H2的转化率为99%.
(3)用细菌冶炼铜时,当黄铜矿中伴有黄铁矿时,可明显提高浸取速率,其原理如图3.
①冶炼过程中,正极周围溶液的pH增大(填“增大”“减小”或“不变”).
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
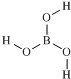 ,由其结构可推知硼酸应属于弱酸(选填“弱”或“强”).
,由其结构可推知硼酸应属于弱酸(选填“弱”或“强”).