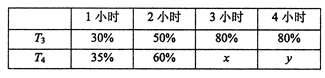
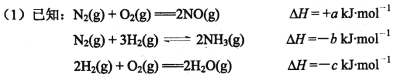题目内容
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A.由图甲知,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲知,A点对应温度下的平衡常数为80
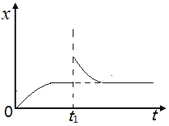
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
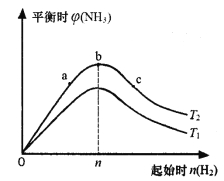
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
【答案】C
【解析】
试题分析:A、甲图中A点时SO2的转化率为0.80,由“三段式”:
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
初始量(mol/L)0.2 0.1 0
变化量(mol/L)0.80×0.2 0.08 0.80×0.2
A点时(mol/L)0.04 0.08 0.16
B点时SO2的转化率为0.85,计算转化的SO2的物质的量为0.85×2=1.7mol,剩余为0.3mol,此时其浓度为0.3mol·L-1,但是并非平衡浓度,A错误;B、A点所在温度下的化学平衡常数为200,B错误;C、缩小容器的容积,增大压强化学平衡正向移动,图乙正确,C正确;D、由图丙判断T1>T2,D错误;答案选C。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】某化学实验小组需要1mol·L-1的CuSO4溶液90ml,现用CuSO4·5H2O晶体来配制,请回答下列问题:
(1)实验时,应用托盘天平称取CuSO4·5H2O晶体 g。
(2)配制过程中,不需要的仪器(填序号) 。
A药匙 B量筒 C烧杯 D玻璃棒 E蒸发皿
完成实验还缺少的玻璃仪器是 。
(3)定容时的操作:当液面接近容量瓶刻度线时, ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)下列操作会使配得的CuSO4溶液浓度偏高的是________。
A.CuSO4·5H2O已失去部分结晶水 |
B.定容时仰视容量瓶的刻度线 |
C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
E.容量瓶内壁附有水珠而未干燥处理