��Ŀ����
����Ŀ����ҵ�ϳɰ���N2��g��+3H2��g��![]() 2NH3��g�� ��H��0�����ֿ��Խ�һ���Ƹ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
2NH3��g�� ��H��0�����ֿ��Խ�һ���Ƹ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺

����68g��������������ȫ����NO��g����H2O��g�����ų�������Ϊ___________KJ��
��2���ϳɰ���Ӧ�ﵽƽ���ijʱ�̸ı�����ѡ���е�__________�������ڴﵽ��ƽ��Ĺ������淴Ӧ����ʼ������
a������ b.��С�ݻ� c������c��N2�� d��ʹ�ô���
��3��ij����С���о����������������������£��ı���ʼ�����������ʵ����Ժϳɰ���Ӧ��Ӱ�졣ʵ��������ͼ��ʾ����ͼ��T��ʾ�¶ȣ������ʾ��ʼʱH2�����ʵ����������ʾƽ��ʱNH3�����������
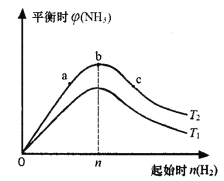
ͼ����T1��T2�Ĺ�ϵ�ǣ�T1____________T2 ������>����<������=������
�Ƚ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת����������_______________������ĸ����
���������ݻ�Ϊ1L��b���Ӧ����ʼʱn��H2��=0.30mol�����ƽ��ʱH2��ת����Ϊ60������ƽ��ʱc��N2��Ϊ_________________mo1��L-1������֪��Ӧ������ʵ�����n��H2����n��N2��=3��1Ͷ��ʱ��ƽ��ʱNH3��������������
��4��һ���¶��£���2mol N2��4mol H2����1L�ĺ����ܱ������з�Ӧ����ò�ͬ�¶���T������ͬʱ����ڹ�ҵ�ϳɰ���Ӧ��N2��ת���ʣ��õ��������±���ʾ��
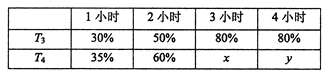
�ϱ���x��y�Ĵ�С��ϵΪx_____________y��������>����=����<�����ݡ������ܡ���
���𰸡���1��3c �C2a�C2b����2��bc����3������ �� ��c ����0.04��4��=��
��������
�����������1����N2��g����O2��g��=2NO��g������N2��g����3H2��g��=2NH3��g������2H2��g����O2��g��=2H2O��g����2������2������3�����ó�4NH3��g����5O2��g��=4NO��g����6H2O��g�� ��H=��2a��2b��3c��kJ��mol��1���������68gNH3�ų�����Ϊ��3c��2a��2b��kJ����2��a�������¶����淴Ӧ���ʶ���������������ԭ����ƽ�����淴Ӧ�����ƶ����淴Ӧ���ʽ��ͣ��ʴ���b����С���������������ѹǿ�����淴Ӧ���ʶ���������������ԭ����ƽ��������Ӧ�����ƶ����淴Ӧ����������ȷ��c����������Ũ�ȣ�ƽ��������Ӧ�����ƶ����淴Ӧ����������ȷ��d��ʹ�ô��������淴Ӧ���ʶ�����ƽ�ⲻ�ƶ����ʴ�����3����b��NH3����������ﵽ���˵���ﵽƽ�⣬�ϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�����T1>T2������������������Ӧ���Ũ������ƽ��������Ӧ�����ƶ�����c��N2��ת����������������������ʵ���Ϊ0.3��60%mol=0.18mol��ͬʱ����N2�����ʵ���Ϊ0.18/3mol=0.06mol����ʼʱͨ��N2�����ʵ���Ϊ0.1mol����˴ﵽƽ��ʱN2�����ʵ���Ϊ��0.1��0.06��mol=0.04mol����ʱc��N2��=0.04/1mol��L��1=0.04mol��L��1����4��T3ʱ��3Сʱ�ﵽƽ�⣬T4��ת���ʱ�T3ʱ��˵��T3���¶ȵ���T4��T4��ѧ��Ӧ���ʴ���T3�����ȴﵽƽ�⣬���x=y��



