��Ŀ����
����Ŀ��������KMnO4����ŨHCl�ķ�Ӧ����ʽ���£�
2KMnO4��16HCl��Ũ��=2KCl��2MnCl2��5Cl2����8H2O
��1������˫���ŷ���������Ӧ�е���ת�Ƶķ������Ŀ��
��2������֪![]() ��������Ϸ�Ӧԭ������MnO2��KMnO4��Cl2����������ǿ������˳���ǣ� ��
��������Ϸ�Ӧԭ������MnO2��KMnO4��Cl2����������ǿ������˳���ǣ� ��
��3��Ũ�����ڷ�Ӧ����ʾ������������ �����ţ�
Aֻ�л�ԭ�� B��ԭ�Ժ����� Cֻ�������� D�����Ժ�����
��4������63.2g������زμӷ�Ӧ����������HCl�����ʵ���Ϊ mol��������Cl2�ڱ�״���µ����Ϊ L��
���𰸡���1��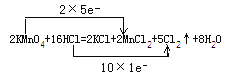 ��
��
��2��KMnO4��MnO2��Cl2����3��B����4��2��22.4 ��
��������
�����������1��KMnO4��Mn���ϼ��ɣ�7������2�ۣ����ϼ۽��ͣ�KMnO4����������HCl��Cl�ɣ�1����0�ۣ�����HCl����ԭ����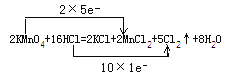 ����2�������������������Դ�����������������ԣ�KMnO4����������Cl2����������������ԣ�KMnO4>Cl2��MnO2��Mn�Ļ��ϼ��ɣ�4������2�ۣ�MnO2����������HCl��Cl�ɣ�1����0�ۣ����ϼ����ߣ�Cl2��������������ԣ�MnO2>Cl2��KMnO4��������ǿ��MnO2��������ǿ����KMnO4>MnO2>Cl2��(3)Ũ����������ǻ�ԭ�������ԣ�(4)���ݵ�ʧ������Ŀ�غ㣬63.2��(7��2)/158=n(HCl)��1�����n(HCl)=2���������������ʵ���63.2��5/(2��158)mol=1mol�������Ϊ22.4L��
����2�������������������Դ�����������������ԣ�KMnO4����������Cl2����������������ԣ�KMnO4>Cl2��MnO2��Mn�Ļ��ϼ��ɣ�4������2�ۣ�MnO2����������HCl��Cl�ɣ�1����0�ۣ����ϼ����ߣ�Cl2��������������ԣ�MnO2>Cl2��KMnO4��������ǿ��MnO2��������ǿ����KMnO4>MnO2>Cl2��(3)Ũ����������ǻ�ԭ�������ԣ�(4)���ݵ�ʧ������Ŀ�غ㣬63.2��(7��2)/158=n(HCl)��1�����n(HCl)=2���������������ʵ���63.2��5/(2��158)mol=1mol�������Ϊ22.4L��

 ��У����ϵ�д�
��У����ϵ�д�

