题目内容
11.下列措施是为了降低化学反应速率的是( )| A. | 保存浓硝酸时,通常用棕色瓶并放在阴凉处 | |
| B. | 用锌与硫酸反应制取氢气时,适当增大硫酸溶液的浓度 | |
| C. | 合成氨的反应中,选择“铁触媒”作催化剂 | |
| D. | 在试管中进行铝和氢氧化钠溶液反应时,稍微加热 |
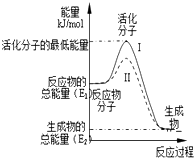
分析 A.棕色试剂瓶能吸收光,且升高温度,促进浓硝酸分解;
B.稀硫酸浓度越大,锌和稀硫酸反应生成氢气反应速率越大;
C.催化剂能降低反应所需活化能,增大反应速率;
D.升高温度加快反应速率.
解答 解:A.棕色试剂瓶能吸收光,且升高温度,促进浓硝酸分解,所以用棕色试剂瓶并放在阴凉处来保存浓硝酸,目的是降低反应速率,故A正确;
B.稀硫酸浓度越大,锌和稀硫酸反应生成氢气反应速率越大,适当增大稀硫酸浓度,增大单位体积内活化分子数,从而增大反应速率,故B错误;
C.催化剂能降低反应所需活化能,增大反应速率,但不影响平衡移动,故C错误;
D.升高温度,增大活化分子百分数,所以加快反应速率,故D错误;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、浓度、催化剂等因素对化学反应速率影响原理是解本题关键,注意催化剂只影响反应速率但不影响平衡移动,易错选项是B,注意:浓硫酸和锌反应生成二氧化硫而不是氢气,为易错点.

练习册系列答案
相关题目
1.112号元素在周期表中的位置是( )
| A. | 第七周期ⅠB族 | B. | 第七周期ⅡB族 | C. | 第六周期ⅠB族 | D. | 第六周期ⅡB族 |
2.已知在苯分子中,不存在单、双键交替的结构.下列可以作为证据的实验事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯中6个碳碳键完全相同
③苯的一溴代物没有同分异构体
④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色.
①苯不能使酸性KMnO4溶液褪色
②苯中6个碳碳键完全相同
③苯的一溴代物没有同分异构体
④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色.
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
16.下列无色溶液中能大量共存的是( )
| A. | Ba2+、Al3+、NO3-、SO42- | B. | Na+、CI-、Ca2+、NO3- | ||
| C. | OH-、NH4+、Na+、SO42- | D. | Fe3+、K+、Cl-、I- |
3.下列有关石油炼制和煤的利用的说法正确的是( )
| A. | 煤的气化、液化和干馏是物理变化 | |
| B. | 通过石油分馏得到的汽油是纯净物 | |
| C. | 石油裂解是为了得到乙烯、丙烯等气态短链烃 | |
| D. | 干馏的产物能提取出苯、甲苯等芳香烃,因为煤中含有苯和甲苯 |
1.4g NaOH溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液物质的量浓度是( )
| A. | 1mol/L | B. | 10mol/L | C. | 0.01mol/L | D. | 0.1mol/L |
 .
.
 (1)已知:
(1)已知: