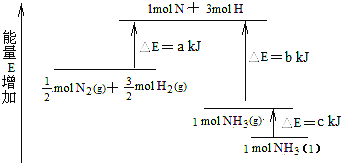��Ŀ����
����Ŀ����14�֣��״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ���ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H����58 kJ/mol
CH3OH��g��+H2O(g) ��H����58 kJ/mol
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H����41 kJ/mol
CO(g)+H2O(g) ��H����41 kJ/mol
�ش��������⣺
��1����֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C | H��O | C��H |
E/��kJ��mol-1�� | 436 | 343 | 1076 | 465 | x |
��x��_________��
��2������lmol CO2��2mol H2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�������CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��
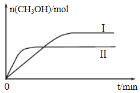
������I������Ӧ��ƽ�ⳣ����С��ϵΪKI_____K��(���������������)��
��һ���¶��£����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_____��
a��������ѹǿ���� b���״���ˮ����������ȱ��ֲ���
c��v����H2����3v����CH3OH�� d��2��C��O���ѵ�ͬʱ��6��H��H����
����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ_________�����¶��µ�ƽ�ⳣ��Ϊ_______���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���________��
a����С��Ӧ�������ݻ� b��ʹ�ú��ʵĴ���
c������He d����ԭ�����ٳ���CO2��H2
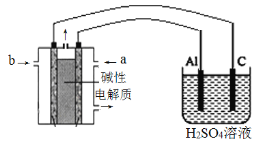
��3���Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�ء��Դ˵������Դ����ʵ������ģ������Ʒ���桰�ۻ����������̣�װ����ͼ��ʾ������������b��_____ �������缫��ӦΪ____ ��
���𰸡�
��1��413��2�֣�
��2��������1�֣�
��ac��2�֣�
��0.06mol/(L��min)��2�֣� 450��2�֣� ad��2�֣�
��3���״���CH3OH����1�֣� 2Al��6e����3H2O��Al2O3��6H����2�֣�
��������
���������
��1����֪����CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H����58 kJ/mol
CH3OH��g��+H2O(g) ��H����58 kJ/mol
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H����41 kJ/mol
CO(g)+H2O(g) ��H����41 kJ/mol
���ݸ�˹���ɿ�֪���������õ���Ӧ������H1����99kJ/mol�����ݱ��м��ܿ�֪1076��2��436��3x��343��465����99�����x��413��
��2�������������ȴﵽƽ��״̬��˵�����������¶ȸ�������I����������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ������У�ƽ�ⳣ����С�����Զ�Ӧ��ƽ�ⳣ����С��ϵΪKI��K����
��a������Ӧ�����С����������ѹǿ����˵���ﵽƽ��״̬��a��ȷ��b�����ݷ���ʽ��֪�״���ˮ�����������ʼ����1��1������˵���ﵽƽ��״̬��b����c��v����H2����3v����CH3OH����ʾ���淴Ӧ������ȣ��ﵽƽ��״̬��c��ȷ��d�����ݷ���ʽ��֪2��C��O���ѵ�ͬʱһ����6��H��H���ѣ�����˵���ﵽƽ��״̬��d����ѡac��
�� CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g)
CH3OH��g��+H2O(g)
��ʼŨ�ȣ�mol/L��0.5 1 0 0
�仯Ũ�ȣ�mol/L��0.3 0.9 0.3 0.3
ƽ��Ũ�ȣ�mol/L��0.2 0.1 0.3 0.3
����CO2��ʾ��ƽ����Ӧ����Ϊ0.3mol/L��5min��0.06mol/(L��min)�����¶��µ�ƽ�ⳣ��Ϊ0.3 ��0.3/0.2��0.13��450��
a������Ӧ�����С����С��Ӧ�������ݻ�ƽ��������Ӧ������У��״��IJ������ߣ�a��ȷ��b��ʹ�ú��ʵĴ���ƽ�ⲻ�ƶ������ʲ��䣬b����c�������ݻ����䣬����He��������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ����Բ�����Ӱ�죬c����d����ԭ�����ٳ���CO2��H2�൱������ѹǿ��ƽ��������Ӧ������У��״��IJ������ߣ�d��ȷ����ѡad��
��3��ģ������Ʒ���桰�ۻ�����������缫�������������Դ����������������a������������b�����Ǽ״�����Ϊ�������ᷢ��������Ӧ�������γ�����Ĥ��������ˮ�μӣ����Ե缫��ӦʽΪ2Al��6e����3H2O��Al2O3��6H����

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�