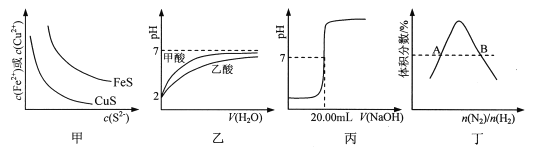
题目内容
【题目】下列叙述中正确的是( )
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 苯、溴水、铁粉混合制成溴苯
C. 沸点:戊烷>丁烷>乙烷
D. 由丙烯加溴制1,2二溴丙烷
【答案】CD
【解析】A.聚乙烯、植物油都是混合物,但聚乙烯中不含碳碳双键,不能使溴的四氯化碳溶液褪色,但植物油含碳碳双键能使溴的四氯化碳溶液褪色,故A错误;B、苯与溴在铁或溴化铁催化下发生取代反应,产物是溴苯,但此反应对溴的状态是由要求的——必须是溴单质,如果是溴水或溴的四氯化碳溶液则不反应;故B错误;C、一般碳原子数越多、相对分子质量越大的烃,熔沸点越高,相对分子质量相同时直连的比支链的熔沸点高。 沸点:戊烷>丁烷>乙烷,故C正确;D、H2C=CHCH3 +Br2 ![]() CH2BrCHBrCH3,故D正确;故选CD。
CH2BrCHBrCH3,故D正确;故选CD。

【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取、性质及应用,进行如下实验。
实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装罝如图所示:

①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体。
(1)上图实验装置中仪器甲的名称为________。冷凝水的进口是________(填“a”或“b” )。
(2)检验淀粉是否水解完全所需要的试剂为______________。
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有________性。反应速率开始很慢,后来逐渐加快,可能的原因是_________。写出反应的离子方程式________________。
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响。”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。设计方案如下:
编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
浓度/molL-1 | 体积/mL | 浓度/molL-l | 体积/mL | ||
甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(4)为了观察到紫色褪去,H2C2O4与KMnO4溶液初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(5)探究温度对化学反应速率影响的实验编号是___________,探究反应物浓度对化学反应速率影响的实验编号是__________。
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100. 0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5ml/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。
(6)计算x= ________。