题目内容
【题目】[化学——选修3:物质结构与性质](15分)
“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O]![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为 ,其价层电子排布图为 。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为 。“摩尔盐”的分解产物中属于非极性分子的化合物是____。
(3)NH3的沸点比N2O的沸点 (填“高”或“低”),其主要原因是 。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为_______ ____,与CN—互为等电子体的单质的分子式为___ _。HCN分子中σ键和π键的个数之比为 。
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为__________,若该晶胞边长为acm,则该晶胞密度为__________。

【答案】
(1)第四周期第Ⅷ族(2分) ![]() (2分)
(2分)
(2)N(1分) SO3(1分)
(3)高(1分) NH3分子间存在氢键(1分)
(4)共价键和配位键(2分) N2(1分) 1∶1(1分)
(5)6(1分) ![]() g/cm3(2分)
g/cm3(2分)
【解析】
试题分析:
(1)铁的原子序数是26,位于第四周期第Ⅷ族;根据核外电子排布规律可知铁的价层电子排布图为![]() 。
。
(2)组成“摩尔盐”的非金属元素有H、N、O、S,其中第一电离能最大的元素为N。三氧化硫是平面三角形结构,属于非极性分子。
(3)NH3分子间存在氢键,因此NH3的沸点比N2O的沸点高。
(4)K3 [Fe(CN)6 ]晶体中,由于Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以Fe3+与CN-之间的化学键类型为配位键,另外C与N之间还有共价键;等电子体是原子数相等,价电子数数也相等的离子或分子,与CN—互为等电子体的单质的分子式为 N2;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,可知亚铁离子配位数为![]() =6;由图可知,该晶胞中亚铁离子个数=8×
=6;由图可知,该晶胞中亚铁离子个数=8×![]() +6×
+6×![]() =4,氧离子个数=1+12×
=4,氧离子个数=1+12×![]() =4,设晶胞边长为acm,晶胞体积为a3cm3,则ρ=
=4,设晶胞边长为acm,晶胞体积为a3cm3,则ρ=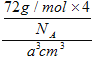 =
=![]() g/cm3。
g/cm3。

【题目】为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
选项 | 混合物 | 除杂试剂 | 分离方法 |
A | 己烷(己烯) | 溴的CCl4溶液 | 分液 |
B | 溴乙烷(乙醇) | 水 | 分液 |
C | 淀粉溶液(NaCl) | 水 | 过滤 |
D | 皂化液(甘油) | NaCl | 盐析,分液 |
A. A B. B C. C D. D