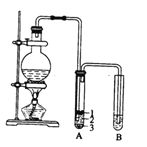
题目内容
【题目】次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是( )
A. 次磷酸的电离方程式为:H3PO2=H++H2PO2-
B. NaH2PO2是次磷酸的正盐,其水溶液呈中性
C. 白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:
P4+9NaOH=3Na2PO2+PH3↑+3H2O
D. 利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
【答案】D
【解析】A.次磷酸是一元中强酸,不能完全电离,其电离方程式为H3PO2![]() H++
H++
H2PO2-,故A错误;B.次磷酸是一元中强酸,NaH2PO2是次磷酸的正盐,但H2PO2-要水解,其水溶液呈碱性,故B错误;C.次磷酸是一元中强酸,白磷与氢氧化钠溶液反应可得次磷酸盐,次磷酸盐的化学式为NaH2PO2,故C错误;D.H3PO2中磷元素的化合价为+1价,1molH3PO2完全氧化为H3PO4,转移4mol电子,最多可还原4molAg+离子,故D正确;答案为D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
A | ||||||||
B | C | |||||||
D | E | F | ||||||
回答下列问题:
(1)元素B的元素符号为______,它在元素周期表中的位置是__________。
(2)D的简单离子的结构示意图为_________,它的最高价氧化物对应水化物中含有的化学键有_____________,D单质与水反应的化学方程式为____________________。
(3)用电子式表示EF2的形成过程_________________________________。
(4)由A2、C2构成碱性燃料电池,则该电池的负极反应方程式为_______________,该电池工作过程中每通过2mol电子所需要的C2体积为___________(标准状况)。
(5)C和D在高温条件下形成化合物的化学式为_________,与二氧化碳反应的化学方程式为_________________________。