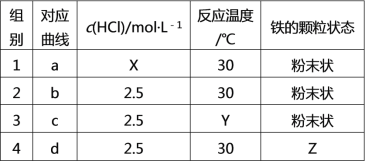题目内容
【题目】(l)![]() =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·![]()
(2)![]() =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·![]()
(3)![]() =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·![]()
(4)![]() =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·![]()
下列关系式中正确的是( )
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
【答案】C
【解析】
A.(1)、(3)氢气燃烧反应是放热反应,反应物相同时,反应产生水是液态时,放出的热量越多,反应热就越小,故c<a<0,A错误;
B.(2)、(4)可知:当反应物相同时,产生的物质含有的能量越高,反应放出的热量就越少,反应热就越大。由于H2O(g)>H2O(l),所以反应热d<b<0,B错误;
C.(1)、(2)反应物、生成物的状态相同,根据参加氢气的物质的量越多,燃烧放出的热量越多,反应热则越少,所以2a=b<0,C正确;
D. (3)、(4)反应物、生成物的状态相同,根据参加氢气的物质的量越多,燃烧放出的热量越多,反应热则越少,所以2c=d<0,D错误;
故合理选项是C。

练习册系列答案
相关题目
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= ![]() ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(/mol/L) | 0.010 | 0.010 | 0.020 |
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢