题目内容
A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失;
C与D反应生成有色沉淀;
B与C反应生成白色沉淀。
写出它们的化学式:
A._________,B._________,C._________,D._________。
解析:此题的特殊之处在于,限定的范围并不是具体的物质,而是阴、阳离子,这样我们要先根据题目提供的阴、阳离子来判断可能出现哪些物质,通过观察发现阴离子中的![]() 是比较特殊的,它与Al3+、Ba2+、Fe3+均可发生反应生成沉淀或气体,从而不能在溶液中形成稳定的化合物,故只可能与K+形成K2CO3,同理可以判断出OH-也只有组成Ba(OH)2。此时再根据题目所提供的实验现象进行判断,已知“A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失”,可推断出A为Ba(OH)2;B中含有Al3+,当Ba(OH)2过量时,生成的Al(OH)3沉淀溶解导致沉淀量减少,但不会完全消失说明沉淀不只是Al(OH)3,根据溶液中所含离子判断另一种沉淀应为BaSO4,故B为Al2(SO4)3。则C、D一为K2CO3,一为Fe(NO3)3。由于“B与C反应生成白色沉淀”,因此C为K2CO3,D为Fe(NO3)3。
是比较特殊的,它与Al3+、Ba2+、Fe3+均可发生反应生成沉淀或气体,从而不能在溶液中形成稳定的化合物,故只可能与K+形成K2CO3,同理可以判断出OH-也只有组成Ba(OH)2。此时再根据题目所提供的实验现象进行判断,已知“A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失”,可推断出A为Ba(OH)2;B中含有Al3+,当Ba(OH)2过量时,生成的Al(OH)3沉淀溶解导致沉淀量减少,但不会完全消失说明沉淀不只是Al(OH)3,根据溶液中所含离子判断另一种沉淀应为BaSO4,故B为Al2(SO4)3。则C、D一为K2CO3,一为Fe(NO3)3。由于“B与C反应生成白色沉淀”,因此C为K2CO3,D为Fe(NO3)3。
答案:Ba(OH)2 Al2(SO4)3 K2CO3 Fe(NO3)3

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为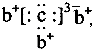 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为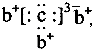 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 Al(OH)3+OH-
Al(OH)3+OH-