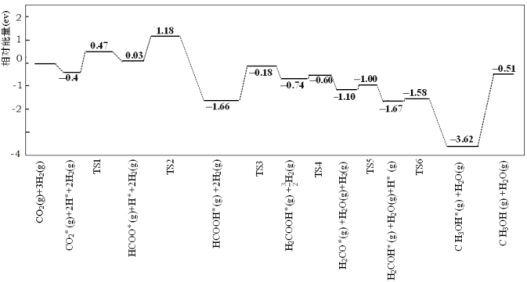
题目内容
【题目】乙酸甲酯是树脂、涂料、油墨、油漆、胶粘剂、皮革生产过程所需的有机溶剂,而且乙酸甲酯还可作为原料制备燃料乙醇。已知:乙酸甲酯可由乙酸和甲醇进行酯化反应得到。请回答下列问题:
(1)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) H1=-874.5kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) H2=-1453kJ/mol
③2CH3COOCH3(l)+7O2(g)=6CO2(g)+6H2O(l) H3=-3189.8kJ/mol
由上述反应,可求出CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l)的H=________![]() 。
。
(2)对于反应CH3COOH(l)+CH3OH(l)CH3COOCH3(l)+H2O(l),判断下列选项可以提高乙酸平衡转化率的是______
A.加入催化剂,增快反应速率
B.加入过量的甲醇
C.加入过量的乙酸
D.将乙酸甲酯从体系中分离
E.适当地提高反应温度
F.适当地降低反应温度
(3)在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇发生了两个反应:
主反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) H<0,
副反应:CH3COOCH3(g)+H2(g) CH3OH(g)+CH3CHO(g) H>0,实验测得,在相同时间内,反应温度与CH3CH2OH和CH3CHO的产率之间的关系如图所示:
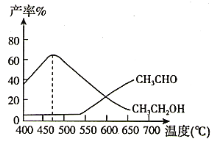
①在540℃之前CH3CHO的产率远低于CH3CH2OH产率的原因是________。
②在470℃之后CH3CHO与CH3CH2OH产率变化趋势可能的原因是________。
(4)若在470℃时,以n(CH3COOCH3):n(H2)=1:10的投料比只进行主反应(不考虑副反应),乙酸甲酯转化率与气体总压强的关系如图所示:
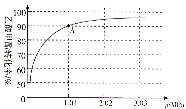
①A点时,CH3COOCH3(g)的平衡分压为________MPa,CH3CH2OH(g)的体积分数________%(保留一位小数)。
②470℃时,该反应的化学平衡常数Kp=________(MPa)-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
【答案】-6.1kJmol-1 BDF 副反应的活化能远大于主反应的活化能,副反应的化学反应速慢 470℃之后,乙醇的产率逐渐降低是该反应是放热反应,温度升高平衡逆向移动,乙醛的产率逐渐升高是反应速率逐渐加快,反应吸热平衡正向移动 0.01MPa 8.9 ![]()
【解析】
(1)依据热化学方程式和盖斯定律进行计算;
(2)A.加入催化剂,增快反应速率,并不会影响平衡移动;
B.加入过量的甲醇,增大了反应物浓度,使平衡正向移动,乙酸的转化率增大;
C.加人过量的乙酸,增大了反应物浓度,虽然使平衡正向移动,但乙酸的转化率降低;
D.将乙酸甲酯从体系中分离,使产物减少,促进平衡正向移动,乙酸的转化率增;
E.根据H为负值,反应正向是放热反应,因此,适当降低温度,平衡正向移动,乙酸的转化率增大;
(3)①两反应快慢的核心是活化能的大小,反应快活化能小,而反应慢活化能大;
②470℃之后,乙醇的产率逐渐降低是该反应是放热反应,温度升高平衡逆向移动,乙醛的产率逐渐升高是反应速率逐渐加快。
(4)利用三段式、化学平衡常数进行计算。
(1)依据热化学方程式和盖斯定律,①+![]() ②-
②-![]() ③可得到CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l),则H=H1+
③可得到CH3COOH(l)+CH3OH(l)=CH3COOCH3(l)+H2O(l),则H=H1+![]() H2-
H2-![]() H3=-6.10 kJmol-1。
H3=-6.10 kJmol-1。
(2)A.加入催化剂,增快反应速率,并不会影响平衡移动,A项错误;
B.加入过量的甲醇,增大了反应物浓度,使平衡正向移动,乙酸的转化率增大,B项正确;
C.加人过量的乙酸,增大了反应物浓度,虽然使平衡正向移动,但乙酸的转化率降低,C项错误;
D.将乙酸甲酯从体系中分离,使产物减少,促进平衡正向移动,乙酸的转化率增大,D项正确;
E.根据H为负值,反应正向是放热反应,因此,适当降低温度,平衡正向移动,乙酸的转化率增大,E项错误,F项正确;
综上所述,答案为BDF。
(3)①两反应快慢的核心是活化能的大小,反应快活化能小,而反应慢活化能大,根据图像可知,副反应的活化能远大于主反应的活化能,副反应的化学反应速慢;
②470℃之后,乙醇的产率逐渐降低是该反应是放热反应,温度升高平衡逆向移动,乙醛的产率逐渐升高是反应速率逐渐加快,反应吸热平衡正向移动。
(4)①由图可看出,转化率为90%时,总压为1.01MPa,已知n(CH3COOCH3):n(H2)=1:10,列三行式求解:
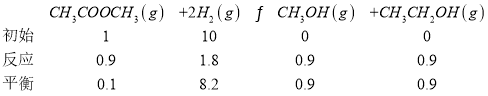
总压为1.01MPa,因此CH3COOCH3(g)的平衡分压为![]() ;CH3CH2OH(g)的体积分数即为物质的量分数,其体积分数
;CH3CH2OH(g)的体积分数即为物质的量分数,其体积分数![]() ;
;
②![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案