题目内容
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol·L-1NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:混合液中H2SO4、HNO3的物质的量浓度各是多少?
(1)c(H2SO4)=4.0mol·L-1 c(HNO3)=6.0mol·L-1
试题分析:加入足量BaCl2溶液,溶液中因生成的是BaSO4沉淀。n(BaSO4)=9.32g÷233g/mol=0.04mol 。所以可以利用守恒推出n(H2SO4)=n(BaSO4)=0.04mol 。再利用
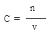 ,则c(H2SO4)=0.04mol÷0.01L=4.0mol·L-1
,则c(H2SO4)=0.04mol÷0.01L=4.0mol·L-1又因为H++OH-=H2O ,n(OH-)=CV=4.0mol·L-1*0.035L=0.14mol,可以知道n (H+)=0.14mol,,因为n(H2SO4)=0.04mol,所以硫酸中H+的物质的量为。结合刚才求出的溶液中H+的总量为0.14mol,可以推出HNO3中H+=0.14 mol-0.08mol=0.06mol。最后C(HNO3)=0.06mol÷0.01L=6.0mol·L-1。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
 分子中含共价键总数为6NA
分子中含共价键总数为6NA