题目内容
【题目】氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
工业合成氨的化学方程式:N2 + 3H2![]() 2NH3+92.4KJ
2NH3+92.4KJ
(1)它是氮的固定的一种,属于_____________(选填“大气固氮”、“生物固氮” “人工固氮”);若升高温度,该平衡向____________方向移动(选填“正反应”或“逆反应”)。
(2)该反应达到平衡状态的标志是______________。(选填编号)
a.压强不变 b.v正(H2)= v正(NH3) c.c (N2)不变 d.c(NH3)= c(N2)
(3)欲使NH3产率增大,可采取的措施有_____________、____________。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则N2的平均反应速率为_________________________________________mol/(LS)。
(4)如下图所示,将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,解释发生该现象的原因____________________________________。
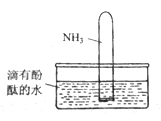
(5)(NH4)2SO4是常用的氮肥,长期施用时会使土壤酸化板结,
用离子方程式表示原因___________________________________
检验(NH4)2SO4含NH4+的方法是____________________。
____________________.
【答案】 人工固氮 逆反应 a c 加压,分离氨(合理即给分) 0.001 氨气易溶于水,试管内压强减小,液面上升 生成一水合氨,电离出OH-,溶液呈碱性,故溶液变为红色。或NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- ,NH3易溶于水,试管内压强减小,液面上升 电离出OH-,溶液呈碱性,故溶液变为红色。(合理即给分) NH4++H2O
NH4++OH- ,NH3易溶于水,试管内压强减小,液面上升 电离出OH-,溶液呈碱性,故溶液变为红色。(合理即给分) NH4++H2O![]() NH3·H2O+H+ 取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
NH3·H2O+H+ 取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
【解析】(1)工业合成氨属于人工固氮;正方应放热,若升高温度,该平衡向逆反应方向移动;(2)a.正反应体积减小,压强不变说明达到平衡状态,a正确;b.v正(H2)=v正(NH3)均表示正反应速率,反应没有达到平衡状态,b错误;c.c(N2)不变说明达到平衡状态,c正确;d.c(NH3)= c(N2)不能说明正逆反应速率相等,不一定处于平衡状态,d错误,答案ac;(3)正反应体积减小,反应放热,因此欲使NH3产率增大,可采取的措施有加压,分离氨。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则消耗氮气是0.04mol,因此N2的平均反应速率为![]() =0.001mol/(Ls)。(4)由于氨气易溶于水,试管内压强减小,液面上升。生成一水合氨,电离出OH-,溶液呈碱性,因此溶液变为红色。(5)铵根水解显酸性,所以长期施用时会使土壤酸化板结,离子方程式为NH4++H2O
=0.001mol/(Ls)。(4)由于氨气易溶于水,试管内压强减小,液面上升。生成一水合氨,电离出OH-,溶液呈碱性,因此溶液变为红色。(5)铵根水解显酸性,所以长期施用时会使土壤酸化板结,离子方程式为NH4++H2O![]() NH3·H2O+H+。铵根能与强碱反应生成碱性气体氨气,则检验(NH4)2SO4含NH4+的方法是取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。
NH3·H2O+H+。铵根能与强碱反应生成碱性气体氨气,则检验(NH4)2SO4含NH4+的方法是取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+。

 名校课堂系列答案
名校课堂系列答案