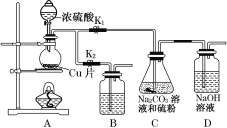
题目内容
【题目】A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号______;
(2)C的阴离子的结构示意图______;
(3)C、D两元素形成的化合物的电子式__________________________。
(4)A、B两元素相比较,A元素的活泼性较强,可以验证该结论的实验是( )
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性.
(5)写出D的氢化物与C的单质1:2反应的化学方程式:______________________。
【答案】(1)Mg;
(2)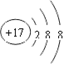 ;
;
(3) ;
;
(4)BC;
(5)CH4+2Cl2![]() CH2Cl2+2HCl。
CH2Cl2+2HCl。
【解析】试题分析:A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6,令最外层电子数为x,则x=(10+x)×1/6,解得x=2,故A为镁元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为铝元素;C-离子核外电子层数比A元素的离子核外电子层数多1,镁离子有2个电子层,则C-离子有3个电子层,核外电子数为18,故C为氯元素;D元素原子最外层电子数是次外层的2倍,则D有2个电子层,最外层电子数为4,则D为碳元素。(1)由上述分析可知A为Mg元素,元素符号是Mg;(2)氯离子质子数为17,核外电子数为18,核外有3个电子层,最外层有8个电
子,氯离子结构示意图为 ;(3)C为氯元素,D为碳元素,二者形成的化合物是CCl4,其电子式是:
;(3)C为氯元素,D为碳元素,二者形成的化合物是CCl4,其电子式是: ;(4) A为镁元素,B是铝元素,元素的金属性越强,其单质遇水或酸反应就越容易,最高价氧化物对应的水化物的碱性就越强。A.将这两种元素的块状单质分别放入冷水中,都不能与冷水反应,错误;B.将这两种元素的单质分别和同浓度的盐酸反应,镁反应较剧烈,可以证明Mg的金属性较强,正确;C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液,Mg可以可热水反应,生成Mg(OH)2,溶液呈碱性,而Al难以反应,可证明Mg的金属性较强,正确;D.两种金属元素都不能形成氢化物,错误,故答案为:BC;(5)D的氢化物是CH4与C的单质Cl2按1:2在光照时发生取代反应产生CH2Cl和HCl,反应的化学方程式是:CH4+2Cl2
;(4) A为镁元素,B是铝元素,元素的金属性越强,其单质遇水或酸反应就越容易,最高价氧化物对应的水化物的碱性就越强。A.将这两种元素的块状单质分别放入冷水中,都不能与冷水反应,错误;B.将这两种元素的单质分别和同浓度的盐酸反应,镁反应较剧烈,可以证明Mg的金属性较强,正确;C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液,Mg可以可热水反应,生成Mg(OH)2,溶液呈碱性,而Al难以反应,可证明Mg的金属性较强,正确;D.两种金属元素都不能形成氢化物,错误,故答案为:BC;(5)D的氢化物是CH4与C的单质Cl2按1:2在光照时发生取代反应产生CH2Cl和HCl,反应的化学方程式是:CH4+2Cl2![]() CH2Cl2+2HCl。
CH2Cl2+2HCl。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案