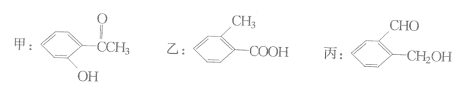
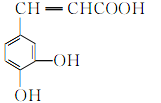题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置I中产生气体的化学方程式为:_________________________________;
(2)要从装置II中获得已析出的晶体,可采取的分离方法是__________________;
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
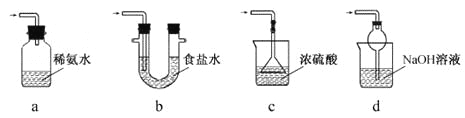
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 过滤 d
【解析】
(1)装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水;
(2)装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体;
(3)处理过量的SO2尾气,既要吸收SO2尾气,同时能防倒吸。
(1)装置Ⅰ是实验室制SO2,产生气体的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)析出晶体,可以用过滤的方法分离;
(3)该装置的尾气是SO2, 选择能与SO2反应的试剂,稀氨水和NaOH溶液和SO2反应,但a装置进气管应插入溶液中,a项错误;选d。

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目