题目内容
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应,且氯水足量)。
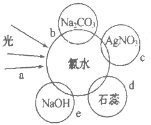
(1)能证明氯水具有漂白性的是___(填“a”“b”“c”或“d”);
(2)c过程中的现象是___;
(3)e过程中的化学方程式为___;
(4)实验室保存饱和氯水的方法是___。
【答案】d 有白色沉淀生成 Cl2+2NaOH=NaCl+NaClO+H2O 在阴凉处置于棕色试剂瓶中密封保存
【解析】
(1)氯水中的HClO有强氧化性,一般在应用其漂白时,HClO的强氧化性将有色物质氧化成无色物质,本题中氯水能使石蕊试液先变红,后褪色,故d能证明氯水具有漂白性;
(2)氯水中有Cl-,加入AgNO3溶液有白色沉淀生成,生成AgCl白色沉淀;
(3)氯水中含有Cl2,Cl2与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O;
(4)因为HClO不稳定,光照易分解,所以实验室保存饱和氯水的方法是在阴凉处置于棕色试剂瓶中密封保存。

【题目】氮化锂(Li3N)常用作固体电解质和催化剂,遇水蒸气反应生成氢氧化锂和氨气,以一瓶氮气样品(含一氧化碳和氧气)制备纯净的氮化锂,其装置如图所示:
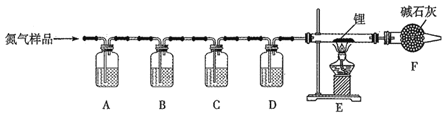
已知:连苯三酚的碱性溶液能吸收少量O2;氯化亚铜的盐酸溶液能吸收少量CO且易被O2氧化。请回答下列问题:
(1)选择下列试剂填入指定位置:
装置代号 | A | B | C | D |
试剂代号 | _____ | ______ | ____ | ____ |
![]() 浓硫酸
浓硫酸 ![]() 氯化亚铜的盐酸溶液
氯化亚铜的盐酸溶液
![]() 连苯三酚的碱性溶液
连苯三酚的碱性溶液 ![]() 氢氧化钠溶液
氢氧化钠溶液
(2)F装置的作用是______________。
(3)实验中,先通入氮气,后点燃酒精灯,目的是_____________。
(4)写出E中反应的化学方程式 ____________。
(5)设计如下装置测定产品纯度:称取a g产品于G烧瓶中,向安全漏斗中加入足量蒸馏水,收集到V mL气体(折合成标准状况)。

①安全漏斗的作用是______________________。
②H装置所装液体可能是________________![]() 填字母
填字母![]() 。
。
![]() 饱和氯化铵溶液
饱和氯化铵溶液 ![]() 煤油
煤油 ![]() 饱和食盐水
饱和食盐水 ![]() 苯
苯
③根据上述数据计算,该氮化锂产品纯度为___________。