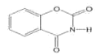
题目内容
【题目】氢化热是指一定条件下,1mol不饱和化合物加氢时放出的热量。表中是环已烯(![]() )。环己二烯(
)。环己二烯(![]() )和苯的氢化热数据。下列说法正确的是
)和苯的氢化热数据。下列说法正确的是
化合物 |
|
|
|
氢化热 | -119.7 | -232.7 | -208.4 |
A.由氢化热数据可推测,环己二烯与![]() 的反应最剧烈
的反应最剧烈
B.环已烯、环己二烯和苯有相同的官能团
C.三种化合物中环己二烯的稳定性最强
D.上述条件下,1mol![]() 转变为
转变为![]() 时放出热量
时放出热量
【答案】D
【解析】
A.断裂1mol碳碳键放出热量越多反应越剧烈;
B.依据环己烯、环己二烯和苯的分子结构分析判断官能团;
C.物质能量越低越稳定;
D.环己二烯转变为环己烯时是和氢气加成完成是放热反应,放热可以依据盖斯定律计算判断;
A.断裂1mol碳碳键环己烯放热为119.7KJ、环己二烯放热为116.35KJ、苯放热69.47KJ,所以环己烯氢化反应剧烈,故A错误;
B.环己烯官能团为一个双键、环己二烯含两个双键、苯分子中是六个碳碳键完全等同的化学键,所以不是有相同的官能团,故B错误;
C.断裂1mol碳碳键环己烯放热为119.7KJ、环己二烯放热为116.35KJ、苯放热69.47KJ,三种化合物中苯的稳定性最强,故C错误;
D.![]() 氢化热为-208.4KJ/mol,
氢化热为-208.4KJ/mol,![]() 氢化热为-232.7KJ/mol;依据盖斯定律②-①得到:
氢化热为-232.7KJ/mol;依据盖斯定律②-①得到:![]()
![]() ,所以1mol环己二烯转变为B苯时放热24.3kJ,故D正确;
,所以1mol环己二烯转变为B苯时放热24.3kJ,故D正确;
故答案选D。

【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备己略)
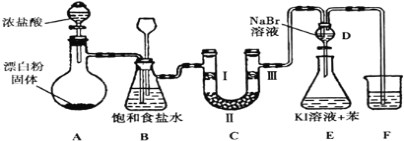
(1)装置A是氯气的发生装置,浓盐酸可与漂白粉的有效成分反应生成氯气。请写出相应反应的化学方程式:__________________________________;装置A部分用来装漂白粉的仪器名称是____________。
(2)装置B中饱和食盐水的作用是___________________________,同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞。请写出C中发生堵塞时B中的现象_________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是___________(填字母编号).
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的验证氧化性强弱顺序:Cl2 >Br2 >I2。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_____________________,该现象______(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是________________。
(5)装置F的作用是___________,其烧杯中的溶液不能选用下列中的____________(填字母编号)。
a.饱和NaOH溶液 b.饱和NaCl溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.