题目内容
【题目】氢氧化锂(LiOH)是重要的初加工锂产品之一,可用于继续生产氟化锂、锰酸锂等,在实验室模拟用天然锂辉石(主要成分是LiAlSi2O6)生产LiOH的一种工艺流程如图所示:
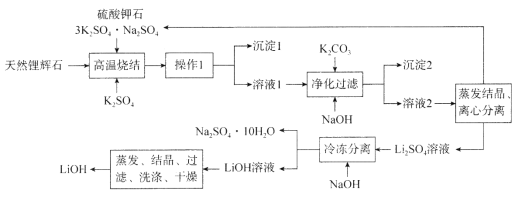
已知:溶液1中含有Li+、K+、Al3+、Na+、Fe3+、![]() 等离子。请回答下列相关问题。
等离子。请回答下列相关问题。
(1)高温烧结的目的是________________________________________________。
(2)操作1是_____________________________。
(3)判断LiOH已洗涤干净的操作是______________________________________________。
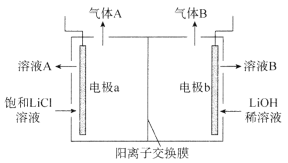
(4)工业生产中通过电解LiC1溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的_________(选填“正极”或“负极”),电极b发生的反应是__________,阳离子交换膜的作用是_________________________________。
【答案】将锂辉石转化为可溶性硫酸盐(答案合理即可) 溶解、过滤(写溶解、过滤、洗涤也可以) 取少量最后一次洗涤液于试管中,加盐酸酸化,再滴加氯化钡溶液,如无白色沉淀,则可判断![]() 已洗涤干净(答案合理即可) 正极
已洗涤干净(答案合理即可) 正极 ![]() (或
(或![]() ) 防止氯气与氢气、
) 防止氯气与氢气、![]() 接触发生反应(答案合理即可)
接触发生反应(答案合理即可)
【解析】
(1)锂辉石难溶于水,通过流程可知,高温烧结后主要成分都转化为了可溶性物质;
(2)高温烧结所得物质为固体,可通过溶解、过滤后得到沉淀1和溶液1。
(1)锂辉石难溶于水,由流程可知,高温烧结后主要成分都转化为了可溶性物质,因此其目的是将锂辉石转化为可溶性硫酸盐,故答案为:将锂辉石转化为可溶性硫酸盐;
(2)高温烧结所得物质为固体,由流程可知,操作1后得到沉淀1和溶液1,因此操作1是溶解、过滤,故答案为:溶解、过滤;
(3)由流程可知,LiOH表面附有硫酸钠,判断LiOH是否洗涤干净可通过检验最后一次洗涤液中是否含有硫酸根来判断,具体操作为取少量最后一次洗涤液于试管中,加盐酸酸化,再滴加氯化钡溶液,如无白色沉淀,则可判断LiOH已洗涤干净,故答案为:取少量最后一次洗涤液于试管中,加盐酸酸化,再滴加氯化钡溶液,如无白色沉淀,则可判断LiOH已洗涤干净;
(4)由示意图可知,电极a处进入的是饱和![]() 溶液,产生的气体应该是氯气,电极b进入的是稀LiOH溶液,产生的气体应该是氢气,因此电极a为阳极,连接电源的正极,电极b为阴极,电极反应式为
溶液,产生的气体应该是氯气,电极b进入的是稀LiOH溶液,产生的气体应该是氢气,因此电极a为阳极,连接电源的正极,电极b为阴极,电极反应式为![]() 或
或![]() ,电解生成的氯气能与氢气和氢氧化锂溶液反应,为防止氯气与氢气、LiOH接触发生反应,应选用阳离子交换膜,故答案为:正极;
,电解生成的氯气能与氢气和氢氧化锂溶液反应,为防止氯气与氢气、LiOH接触发生反应,应选用阳离子交换膜,故答案为:正极;![]() (或
(或![]() );防止氯气与氢气、
);防止氯气与氢气、![]() 接触发生反应。
接触发生反应。

【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变