题目内容
【题目】硫元素的几种化合物存在下列转化关系:
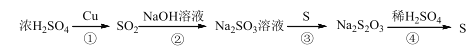
下列判断正确的是
A.反应①中生成的SO2具有还原性,故可作漂白剂
B.反应④中当消耗1mol稀硫酸时,电子转移为6mol
C.可以用CS2清洗做过实验③后附着在试管壁上的硫
D.反应④生成S的原子利用率是100%
【答案】C
【解析】
A、SO2中的S元素是+4价,既有氧化性又有还原性,而作漂白剂是利用它与品红等有机有色物质发生化合反应,生成无色不稳定物质所致,与其氧化性、还原性没有因果关系,选项A错误;
B、反应④Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O中当消耗1mol稀硫酸时,电子转移为2mol,选项B错误;
C、S易溶于CS2,可以用CS2清洗做过实验③后附着在试管壁上的硫,选项C正确;
D、反应④Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,生成S的原子利用率不是100%,选项D错误。
答案选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。




