题目内容
短周期元素X、Y、Z在元素周期表中的位置如下图所示。下列说法正确的是
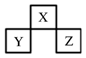

| A.原子半径的大小为:Z>Y>X |
| B.若Y的氧化物为两性氧化物,则X、Z分别形成单质的微观结构中均可能具有正四面体构型 |
| C.若X的氢化物与Z的最高价氧化物对应水化物能反应,则生成的盐仅有一种 |
| D.若Y与Z的核电荷数之和为X的4倍,则X、Z形成的对应氢化物的熔沸点前者高于后者 |
BD
A:同周期元素自左至右原子半径依次减小,即Y>Z,不正确
B:Y为铝元素,则X、Z分别为碳与磷,碳的单质金刚石中碳原子之间为空间正四面构型,白磷分子为空心正四面体构型,正确
C:X为氮、Z为硫,氨气与硫酸可生成两种盐:硫酸铵及硫酸氢铵,不正确
D:设X的质子数为x,则Y、Z的质子数分别为x+7、x+9,依题意可知x=8,则X、Z分别为O与Cl元素:水为液态,而HCl为气态,正确
答案为BD
B:Y为铝元素,则X、Z分别为碳与磷,碳的单质金刚石中碳原子之间为空间正四面构型,白磷分子为空心正四面体构型,正确
C:X为氮、Z为硫,氨气与硫酸可生成两种盐:硫酸铵及硫酸氢铵,不正确
D:设X的质子数为x,则Y、Z的质子数分别为x+7、x+9,依题意可知x=8,则X、Z分别为O与Cl元素:水为液态,而HCl为气态,正确
答案为BD

练习册系列答案
相关题目
 ,说明该元素与氧元素的非金属性的强弱______________________
,说明该元素与氧元素的非金属性的强弱______________________ __。
__。