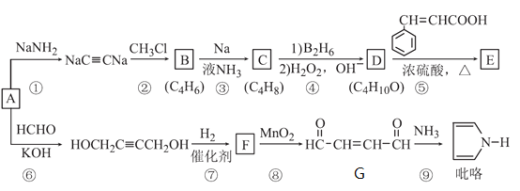
题目内容
【题目】硫酸铝主要用作造纸工业中的沉淀剂和饮用水的絮凝剂。用铝灰(Al2O3、SiO2和少量铁的氧化物)制备硫酸铝晶体[Al2(SO4)3·18H2O]的工艺流程如图所示:
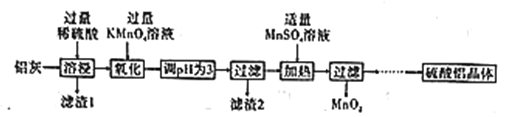
(1)滤渣1的化学式为____。
(2)“氧化”步骤的离子方程式为____。
(3)已知:相关离子生成氢氧化物沉淀的pH范围如表:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调节pH为3的目的是________。
(4)“加热”步骤中反应的生成物中氧化产物与还原产物的物质的量之比为_____。
(5)“…”中一系列操作是___、冷却结晶、过滤、___、干燥。
(6)硫酸铝晶体加热发生分解的失重曲线如图所示,主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。
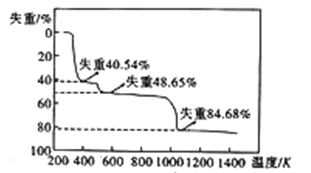
①失重第一阶段残留固体的化学式为_________。
②失重第三阶段反应的化学方程式为_________。
【答案】SiO2 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O 使Fe3+完全沉淀,而Al3+不沉淀,将Fe3+除去 3:2 蒸发(或加热)浓缩 洗涤 Al2(SO4)3·3H2O Al2(SO4)3![]() Al2O3+3SO3↑
Al2O3+3SO3↑
【解析】
用含有Al2O3、SiO2和少量铁的氧化物的铝灰制备Al2(SO4)318H2O,结合流程可知,水洗过滤,再加硫酸得到的固体为SiO2,滤液中含Al3+、Fe3+、Fe2+,加入KMnO4或H2O2等氧化剂是把Fe2+氧化为Fe3+,调pH目的是使Fe3+生成Fe(OH)3沉淀而除去,加入MnSO4,依据溶液紫红色消失及产物,可知MnSO4与KMnO4发生反应生成MnO2沉淀而除去MnO4-,滤液含Al2(SO4)3,蒸发浓缩、冷却结晶得到Al2(SO4)318H2O,以此来解答。
(1)铝灰的成分中只有SiO2不与硫酸反应,因此,滤渣1为SiO2;
(2)加入高锰酸钾的作用是将二价铁氧化为三价铁,离子反应方程式为:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O;
(3)为使Fe3+完全沉淀,而Al3+不沉淀,将Fe3+除去,根据表格中数据,溶液的pH值为3;
(4)加入MnSO4,依据溶液紫红色消失,可知MnSO4与KMnO4发生反应生成MnO2沉淀而除去MnO4,溶液呈酸性配平电荷时用H+配平,离子反应为:
3Mn2++2MnO4+2H2O═5MnO2↓+4H+,根据方程式可得还原剂为Mn2+,氧化剂为MnO4,MnO2既是氧化产物又是还原产物。生成物中氧化产物与还原产物的物质的量之比为3:2;
(5)又溶液变为晶体操作方法为蒸发(或加热)浓缩、冷却结晶、过滤、洗涤、干燥。
(6)硫酸铝晶体中结晶水的含量为![]() ×100%=48.65%,故第二阶段完全失去结晶水,得到的物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为666×40.54%÷18=15,故第一阶段得到的物质为Al2(SO4)3·3H2O,第三阶段剩余物质的相对分子质量为666×(1-84.68%)=102,应是Al2O3,故反应方程式为Al2(SO4)3
×100%=48.65%,故第二阶段完全失去结晶水,得到的物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为666×40.54%÷18=15,故第一阶段得到的物质为Al2(SO4)3·3H2O,第三阶段剩余物质的相对分子质量为666×(1-84.68%)=102,应是Al2O3,故反应方程式为Al2(SO4)3![]() Al2O3+3SO3↑。
Al2O3+3SO3↑。

 名校课堂系列答案
名校课堂系列答案【题目】有4支试管中分别进行如下表所示实验,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
C | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 通入过量CO2气体 | 生成白色沉淀 | 原溶液中只有AlO |
A. A B. B C. C D. D