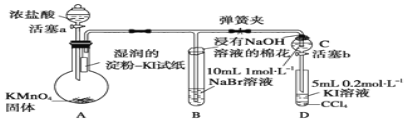
题目内容
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g 14CO与15N2的混合气体所含质子数为7.5NA
B.11.2L Cl2与NaOH溶液反应,转移电子数为0.5NA
C.2mol SO2与1mol O2反应生成SO3的分子数为2NA
D.6g MgSO4与NaHSO4的混合物所含氧原子数为0.2NA
【答案】D
【解析】
A.14CO与15N2的摩尔质量都是30g·mol 1,并且1个14CO分子与1个15N2分子所含的质子数都是14,所以15 g 14CO与15N2的混合气体的物质的量为![]() =0.5mol,所含的质子数为7NA,A错误;
=0.5mol,所含的质子数为7NA,A错误;
B.未指明标况, 11.2L Cl2的物质的量无法确定,B错误;
C.SO2与 O2在一定条件下反应生成SO3的反应是一个可逆反应,反应物的转化率小于100%,故2mol SO2与1mol O2反应生成SO3的分子数小于2NA,C错误;
D.MgSO4与NaHSO4的摩尔质量都是120g·mol 1,6g MgSO4与NaHSO4的混合物的物质的量为![]() =0.05mol,所含氧原子数为4×0.05mol×NA=0.2NA,D正确;
=0.05mol,所含氧原子数为4×0.05mol×NA=0.2NA,D正确;
答案选D。

【题目】硫酸铝主要用作造纸工业中的沉淀剂和饮用水的絮凝剂。用铝灰(Al2O3、SiO2和少量铁的氧化物)制备硫酸铝晶体[Al2(SO4)3·18H2O]的工艺流程如图所示:
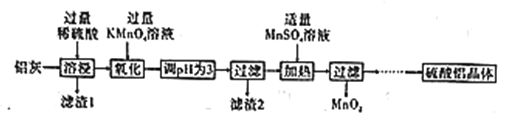
(1)滤渣1的化学式为____。
(2)“氧化”步骤的离子方程式为____。
(3)已知:相关离子生成氢氧化物沉淀的pH范围如表:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调节pH为3的目的是________。
(4)“加热”步骤中反应的生成物中氧化产物与还原产物的物质的量之比为_____。
(5)“…”中一系列操作是___、冷却结晶、过滤、___、干燥。
(6)硫酸铝晶体加热发生分解的失重曲线如图所示,主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。

①失重第一阶段残留固体的化学式为_________。
②失重第三阶段反应的化学方程式为_________。