题目内容
【题目】I.1100OC时,在恒容密闭容器中,发生可逆反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
并达到平衡,请完成下列各题:
(1)达到平衡时的平衡常数表达式K=_______________。降低温度,K值减小,则正反应为____________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
A.正向移动 B.逆向移动 C.不发生移动
①加入少量Na2SO4,则平衡:__________(填所选字母)
②加入少量灼热的Fe3O4 ,则平衡:_________(填所选字母)
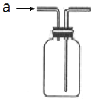
II.将CH4设计成燃料电池,其利用率更高,装置示意如右图

(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①0<V≤44.8L时,电池总反应方程式为________________;
②44.8L<V≤89.6L时,负极电极反应为_________________;
③V=67.2L时,溶液中阴离子浓度大小关系为____________;
【答案】(14分)I.(1)K=c4(H2O)/c4(H2) 吸热
(2)①不发生移动②逆向移动
II.①CH4+2O2+2KOH=K2CO3+3H2O
②CH4-8e-+9CO32-+3H2O=10HCO3-
③c(HCO3-)>c(CO32-)>c(OH-)(每空均2分)
【解析】
试题分析:I.(1)Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g),固体不写在平衡常数表达式中,平衡常数K=
Na2S(s)+4H2O(g),固体不写在平衡常数表达式中,平衡常数K=![]() ,降低温度,K值减小,说明平衡逆向进行,逆反应方向是放热反应,正反应方向为吸热反应;
,降低温度,K值减小,说明平衡逆向进行,逆反应方向是放热反应,正反应方向为吸热反应;
(2)①加入少量Na2SO4,硫酸钠是固体不允许化学平衡和反应速率,则平衡不发生移动;
②加入少量灼热的Fe3O4,氢气和四氧化三铁反应生成铁和水,则平衡Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g),向逆向进行;
II.n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O;
②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-;
③当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案