题目内容
【题目】关于下列各图的叙述,正确的是( )
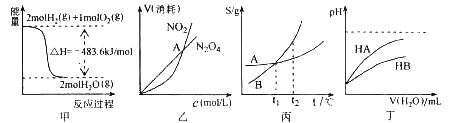
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJmol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
【答案】C
【解析】
试题分析:A.在101kPa时,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量.使用燃烧热时要注意两个关键点:①反应物用量:可燃物为1mol;②产物要求:充分燃烧成稳定氧化物(如H→H2O),本题生成的水为气体,不是燃烧热,故A错误;B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)N2O4(g)中,各物质的浓度与其消耗速率之间的关系,横坐标向右表示浓度增大,纵坐标向上表示物质消耗速率快,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于2:1,故B错误;C.将A、B饱和溶液分别由T1℃升温至T2℃时两溶液中溶质和溶剂的量都不会改变,而二者T1℃溶解度相同,即浓度相同,所以T2℃时溶质的质量分数相等,故C正确;D.常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化可知酸性HA大于HB,所以NaB溶液中B水解程度大,即同浓度的NaA溶液的pH小于NaB溶液,故D错误;故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目