题目内容
有下列操作,对实验现象的描述,或由现象作出的判断错误的是
- A.向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色
- B.向紫红色的酸性KMnO4溶液滴入足量的Na2SO3溶液,溶液紫红色褪去
- C.向FeCl2溶液中滴入NaOH溶液,生成白色沉淀立即变灰绿色、最后变为红棕色
- D.向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成,则说明原溶液中含SO42-
D
分析:A、根据过氧化钠具有强氧化性,能与水反应生成NaOH和氧气分析;
B、高锰酸钾具有强氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应;
C、根据氢氧化亚铁不稳定分析;
D、根据生成的沉淀可能为AgCl、BaSO4来分析.
解答:A、过氧化钠与水反应生成NaOH和氧气,溶液呈碱性,滴加酚酞变红,过氧化钠具有强氧化性,能使溶液褪色,故A正确;
B、高锰酸钾具有强氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应而使酸性高锰酸钾褪色,故B正确;
C、向FeCl2溶液中滴入NaOH溶液,生成Fe(OH)2,Fe(OH)2不稳定,易与空气中氧气反应生成Fe(OH)3,现象是生成白色沉淀立即变灰绿色、最后变为红棕色,故C正确;
D、向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成,生成的沉淀可能为AgCl、BaSO4,溶液中可能含有Cl-、SO42-、SO32-,故D错误.
故选D.
点评:本题考查元素化合物的性质,题目难度不大,本题主要常见元素化合物的性质和Cl-、SO42-、SO32-的检验.
分析:A、根据过氧化钠具有强氧化性,能与水反应生成NaOH和氧气分析;
B、高锰酸钾具有强氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应;
C、根据氢氧化亚铁不稳定分析;
D、根据生成的沉淀可能为AgCl、BaSO4来分析.
解答:A、过氧化钠与水反应生成NaOH和氧气,溶液呈碱性,滴加酚酞变红,过氧化钠具有强氧化性,能使溶液褪色,故A正确;
B、高锰酸钾具有强氧化性,亚硫酸钠具有还原性,二者发生氧化还原反应而使酸性高锰酸钾褪色,故B正确;
C、向FeCl2溶液中滴入NaOH溶液,生成Fe(OH)2,Fe(OH)2不稳定,易与空气中氧气反应生成Fe(OH)3,现象是生成白色沉淀立即变灰绿色、最后变为红棕色,故C正确;
D、向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成,生成的沉淀可能为AgCl、BaSO4,溶液中可能含有Cl-、SO42-、SO32-,故D错误.
故选D.
点评:本题考查元素化合物的性质,题目难度不大,本题主要常见元素化合物的性质和Cl-、SO42-、SO32-的检验.

练习册系列答案
相关题目
(12分)(1)下列实验操作或对实验事实的叙述正确的是__(填序号)
| A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液。 |
| B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水。 |
| C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中。 |
| D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯。 |
F.用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质。
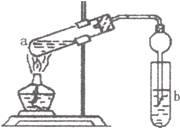
(2)如右图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2S04并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
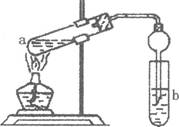
①加人浓H2S04的作用是______________________________________
②试管b中观察到的主要现象是_________________________________
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________________________
④饱和Na2C03溶液的作用是__________________________________
 (1)下列实验操作或对实验事实的叙述正确的是
(1)下列实验操作或对实验事实的叙述正确的是