题目内容
(12分)(1)下列实验操作或对实验事实的叙述正确的是__(填序号)
| A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液。 |
| B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水。 |
| C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中。 |
| D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯。 |
F.用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质。
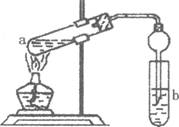
(2)如右图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2S04并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
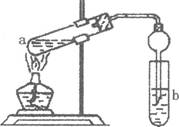
①加人浓H2S04的作用是______________________________________
②试管b中观察到的主要现象是_________________________________
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________________________
④饱和Na2C03溶液的作用是__________________________________
(1)B、F (4分)(多选、错选不得分,漏选得2分)
(2)(每空2分,共8分)①催化剂、吸水剂 ②上层出现无色油状液体 ③防倒吸
④减少乙酸乙酯在溶液中的溶解,除去乙酸溶解乙醇(答一项即可)
解析

练习册系列答案
相关题目
(12分) (1)下列曲线分别表示元素某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面的元素有关性质相符合的曲线的标号填入相应括号中。
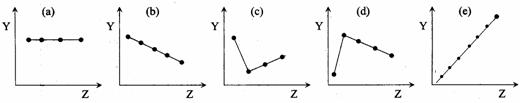 |
① ⅡA族元素的最外层电子数( ) ② ⅦA族元素氢化物的沸点( )
③ O2-、F-、Na+、Mg2+、Al3+的离子半径( ) ④第三周期元素的最高化合价( )
⑤ 第二周期元素Be、B、C、N、O的原子半径( )
(2) 比较下列性质(用“>”、“=”、“<”填空)
① 氧化性 Cl2 Br2 ② 酸性 H3PO4 H2SO4 ③ 碱性 Mg(OH)2 Al(OH)3
④ 稳定性 H2S H2O ⑤ 还原性H2S HCl
(3) 元素性质呈周期性变化的决定因素是 。
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化