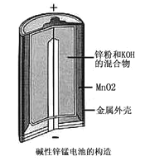
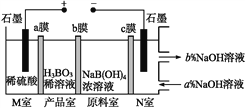
题目内容
【题目】下列说法正确的是( )
A.由“C(石墨)=C(金刚石) ΔH= +1.9kJ·mol-1”可知,金刚石比石墨稳定
B.500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH= -38.6kJ·mol-1
2NH3(g) ΔH= -38.6kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.X(g)+Y(g)![]() Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
Z(g) ΔH >0,恒温恒容条件下达到平衡后加入X,上述反应ΔH增大
【答案】C
【解析】
A.ΔH=+1.9kJ/mol,为吸热反应,则石墨的能量低,则石墨比金刚石稳定,故A错误;
B.0.5mol N2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,则1molN2(g)完全反应放出热量大于38.6kJ,可知N2(g)+3H2(g)2NH3(g) ΔH<38.6kJmol1,故B错误;
C.醋酸是弱酸,在水溶液中没有完全电离,醋酸电离时吸热,所以1molCH3COOH与1mol NaOH溶液反应放热少于强酸,故C正确;
D.一定条件下,反应热与平衡移动无关,与化学计量数与物质的状态有关,故D错误;
故答案选C。

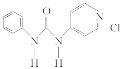
【题目】西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
分子式 | C12H10ClN3O |
结构简式 |
|
外观 | 白色结晶粉末 |
熔点 | 170~172℃ |
溶解性 | 易溶于水 |
(1)氯吡苯脲晶体中,氮原子的杂化方式为___。
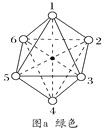
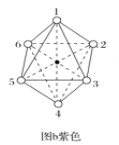
(2)两种组成均为CoCl3·4NH3的配合物分别呈绿色和紫色。已知绿色的配合物内界结构对称,请在图a和图b中用元素符号标出氯原子的位置___、___。