��Ŀ����
����Ŀ����������ȵ���Ƭ��ͭƬ �õ����������� 500mL ����ͭ��Һ�й�����ͼ 1 ��װ �ã������¾����跴Ӧ��������Һ������䣩��

��1����Ƭ�ϵĵ缫��ӦʽΪ___________________________��
��2���� 2 min ������Ƭ��ͭƬ֮���������Ϊ 1.2g�����㣺
�ٵ����������ĵ��ӵ����ʵ���Ϊ_________mo1��
��3����һ��ʱ�������Ƭ������ 2.4g��ͬʱͭƬ������ 3.2g���������ʱ�� �ڸ�װ�����ĵĻ�ѧ��ת��Ϊ���ܵİٷֱ�Ϊ_____��
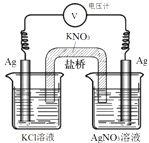
��4��������װ�ø�Ϊ��ͼ 2 ��ʾ��װ��Ҳ�ܴﵽ��ԭװ����ͬ�����á����� KCl ��Һ��ͨ������Һ�γɱպϻ�·�����ã�ͬʱ������ֹ��Ӧ��ֱ�ӽӴ��� ������ͭ��ҺӦ��ע��_________ ����������������Ҳ����������������ձ��С�

���𰸡� Fe��2e��=Fe2�� 0.02 50% �Ҳ�
�������������������������ȵ���Ƭ��ͭƬ�õ����������� 500mL ����ͭ��Һ�й���ԭ��أ����Ļ����Դ���ͭ���������Ǹ�����ͭ������������ܷ�ӦΪ![]() ��������ӦΪFe��2e��=Fe2����������ӦΪ
��������ӦΪFe��2e��=Fe2����������ӦΪ![]() ��
��
�������������Ϸ�������1�����Ļ����Դ���ͭ����Ƭ�Ǹ�����������ӦʽΪFe��2e��=Fe2����
��2������![]() �������ܽ��������ʵ�������������ͭ�����ʵ���������� 2 min ������Ƭ��ͭƬ֮���������Ϊ1.2g���踺���ܽ��������ʵ���Ϊxmol����56x+64x=1.2��x=0.01mol�����ݸ�����ӦʽFe��2e��=Fe2���������������ĵ��ӵ����ʵ���Ϊ0.02mo1��
�������ܽ��������ʵ�������������ͭ�����ʵ���������� 2 min ������Ƭ��ͭƬ֮���������Ϊ1.2g���踺���ܽ��������ʵ���Ϊxmol����56x+64x=1.2��x=0.01mol�����ݸ�����ӦʽFe��2e��=Fe2���������������ĵ��ӵ����ʵ���Ϊ0.02mo1��
��3��ͭƬ������3.2g����ͨ�����ߵĵ��ӵ����ʵ�����![]() ��ת��Ϊ�������ĵ���Ϊ0.05mol����ֱ��������ͭ��Ӧ���ĵ���Ϊxmol������
��ת��Ϊ�������ĵ���Ϊ0.05mol����ֱ��������ͭ��Ӧ���ĵ���Ϊxmol������![]() ������ͭxmol����
������ͭxmol����![]() ��x=0.05mol���������ʱ���ڸ�װ�����ĵĻ�ѧ��ת��Ϊ���ܵİٷֱ�Ϊ
��x=0.05mol���������ʱ���ڸ�װ�����ĵĻ�ѧ��ת��Ϊ���ܵİٷֱ�Ϊ![]() ��
��
��4����װ������ֹ��Ӧ��ֱ�ӽӴ�����������ͭ��ҺӦ��ע���Ҳ���ձ��С�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�