��Ŀ����
����Ŀ����嫵ĺ������̲��ŷḻ�Ļ�ѧ��Դ�����ú�ˮ������ȡ���þ����ȡ�������£�
��1����Ԫ�������ڱ��е�λ����___��
��2����ȡ��Ĺ����У�����2��Br-��Br2ת����Ŀ����___��
��3���������з�����Ӧ�����ӷ���ʽ��___��
��4�����ƽ���ƶ�ԭ�����ͼ�ʯ���������___��
��5����ԭ�ӽṹ֪ʶ����Na�Ľ�����ǿ��Mg��ԭ��___��
��6����ҵ�ϳ�������������������������ʵ�ֺ�ˮ���壬��1m3��ˮŨ����1L��ʹ�ø÷����յõ�36gBr2������ȡ��Ϊ60%����ԭ��ˮ�����Ũ��Ϊ___mg/L��
���𰸡���������VIIA�� ������Ԫ�� SO2+2H2O+Br2=4H++2Br-+SO42- Ca(OH)2+Mg2+![]() Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2���� Na��Mg��Ϊ��������Ԫ�أ�Na���������1�����ӣ�Mg���������2�����ӣ�Na������ʧȥ���ӣ�����Na�Ľ�����ǿ��Mg 120
Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2���� Na��Mg��Ϊ��������Ԫ�أ�Na���������1�����ӣ�Mg���������2�����ӣ�Na������ʧȥ���ӣ�����Na�Ľ�����ǿ��Mg 120
��������
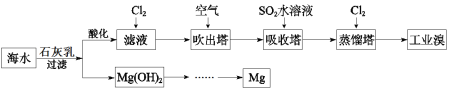
������ʾΪ��ˮ��Դ���ۺ����ã���ˮ�м���ʯ���飬�õ�������þ������ĸҺ����������þ��������һϵ�еIJ��������ջ�õ�����þ������ĸҺ�ữ����������Br�D������Ȼ�����ȿ�������������Br2������������SO2���仹ԭ�����������ã���������������������õ��嵥�ʡ�
��1����Ԫ�������ڱ��е�λ���ǵ�������VIIA�壻
��2�����ݷ�������֪��ȡ��Ĺ����У�����2��Br-��Br2ת����Ŀ���Ǹ�����Ԫ�أ�
��3���������з�����ӦSO2��Br2��ԭ�����ӷ���ʽ��SO2+2H2O+Br2=4H++2Br-+SO42-��
��4��ʯ����Ϊ�������Ƶ�����Һ��Ca(OH)2+Mg2+![]() Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2������
Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2������
��5��Na��Mg��Ϊ��������Ԫ�أ�Na���������1�����ӣ�Mg���������2�����ӣ�Na������ʧȥ���ӣ�����Na�Ľ�����ǿ��Mg��
��6��ʹ�ø÷����յõ�36gBr2����Brԭ�ӵ�����Ϊ72g����ȡ��Ϊ60%��ԭ��ˮ�е�Brԭ�ӵ�����Ϊ72g��60%=120g����ԭ��ˮ�����Ũ��Ϊ120��1000mg��1000L=120mg/L

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�