题目内容
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
【答案】B
【解析】
为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答该题。
解:![]() 将铁块换为等质量的铁粉,增加接触面积加快化学反应速率,故正确;
将铁块换为等质量的铁粉,增加接触面积加快化学反应速率,故正确;
![]() 加入
加入![]() 固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误;
固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误;
![]() 加入少量
加入少量![]() 固体,铁置换出铜,形成原电池反应,可加快反应速率,故正确;
固体,铁置换出铜,形成原电池反应,可加快反应速率,故正确;
![]() 加入少量水,浓度减小,则反应速率减小,故错误;
加入少量水,浓度减小,则反应速率减小,故错误;
![]() 升高温度,反应速率增大,故正确;
升高温度,反应速率增大,故正确;
![]() 将稀硫酸换成
将稀硫酸换成![]() 硫酸,常温下铁会钝化,无法产生氢气,故错误;
硫酸,常温下铁会钝化,无法产生氢气,故错误;
故选:B。

【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)选用的指示剂是______________________。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的横线处。
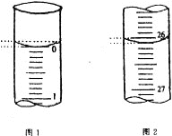
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | 0.00 | ________ | _______ |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= _________。
(6)滴定终点的判定依据是_______________。
【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
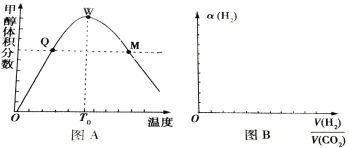
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。