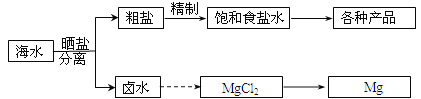
题目内容
【题目】部分弱酸的电离平衡常数如表:

(1)上表的6种酸进行比较,酸性最弱的是:_____;HCOO-、S2-、HSO3-三种离子中,最难结合H+的是__________。
(2)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:___。
(4)下列离子方程式书写正确的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)将少量的SO2通入Na2C2O4溶液,写出离子方程式___。
(6)已知HX为一元弱酸。HX的电离常数为5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,计算某些物质的量:Na2CO3______、NaHCO3______。
【答案】H2S HSO3﹣ H2C2O4、HCOOH、HC2O4﹣ 2HNO2+H2S=2H2O+2NO↑+S↓ DE SO2+H2O+C2O42-=HC2O4-+HSO3﹣ 0mol 6mol
【解析】
(1)相同温度下,酸的电离平衡常数越小,其酸性越弱,弱酸的酸性越强,其酸根离子水解程度越小,则结合氢离子能力越弱;
(2)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数大小判断;
(3)HNO2和H2S发生氧化还原反应,生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,据此书写方程式;
(4)强酸能和弱酸的盐反应生成弱酸和强酸盐;
(5)将少量的SO2通入Na2C2O4溶液,酸性H2C2O4>H2SO3>HC2O4->HSO3-,据此写出离子方程式;
(6)已知HX为一元弱酸,某混合溶液中含有4mol NaX、2mol Na2CO3和1molNaHCO3,NaX、NaHCO3能共存,说明HX的酸性强于碳酸氢根离子,往溶液中通入3mol
CO2气体,充分反应后,气体全部被吸收,说明HX的酸性弱于碳酸,即溶液中除了发生Na2CO3+CO2+H2O=2NaHCO3,还发生反应NaX+CO2+H2O=HX+NaHCO3,根据反应方程式进行计算。
(1)相同温度下,酸的电离平衡常数越小,其酸性越弱,弱酸的酸性越强,其酸根离子水解程度越小,则结合氢离子能力越弱,根据电离平衡常数知,酸性最弱的是H2S,酸性最强的是H2SO3,所以结合氢离子能力最弱的是HSO3-;
(2)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数知,被OH﹣先后消耗的酸及酸式酸根依次是H2C2O4、HCOOH、HC2O4-;
(3)HNO2和H2S生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,该反应方程式为2HNO2+H2S=2H2O+2NO↑+S↓;
(4)A.HNO2具有强氧化性,HS-具有还原性,二者能发生氧化还原反应,根据电子守恒、电荷守恒、离子守恒,可得反应的离子方程式为H++2HNO2+HS-=2NO↑+S↓+2H2O,A错误;
B.酸性:H2SO3>HCOOH>HSO3-,所以HCOOH和SO32-反应生成HCOO-和HSO3-,反应的离子方程式为HCOOH+SO32-=HCOO-+HSO3-,B错误;
C.酸性:H2SO3>HCOOH>HSO3-,所以H2SO3和HCOO-反应生成HCOOH、HSO3-,反应的离子方程式为H2SO3+HCOO-=HCOOH+HSO3-,C错误;
D.亚硫酸和亚硫酸根离子反应生成亚硫酸氢根离子,离子方程式为H2SO3+SO32-=2HSO3-,D正确;
E.根据电离平衡常数可知,H2C2O4的一级电离平衡常数大于HNO2,二级电离平衡常数小于HNO2,所以H2C2O4+NO2-=HC2O4-+HNO2,E正确;
故合理选项是DE;
(5)将少量的SO2通入Na2C2O4溶液,酸性H2C2O4>H2SO3>HC2O4->HSO3-,据此离子方程式为:SO2+H2O+C2O42-=HC2O4-+HSO3-;
(6)已知HX为一元弱酸,某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3,NaX、NaHCO3能共存,说明HX的酸性强于HCO3-,往溶液中通入3molCO2气体,充分反应后,气体全部被吸收,说明HX的酸性弱于H2CO3,溶液中发生的反应有:Na2CO3+CO2+H2O=2NaHCO3,根据该反应可知2molNa2CO3能生成4molNaHCO3同时消耗二氧碳2molCO2,还有1molCO2发生反应NaX+CO2+H2O=HX+NaHCO3,生成1molNaHCO3,所以溶液中没有Na2CO3,Na2CO3的物质的量是0,NaHCO3的物质的量为1mol+4mol+1mol=6mol。