题目内容
(2011?江西一模)乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
(1)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为
(2)Ca2+的原子结构示意图: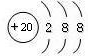
 ;已知CaC2中
;已知CaC2中
与
互为等电子体,
的电子式可表示为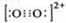
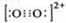 ;1mol
;1mol
中含有的π键数目为
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中含有的哑铃形
的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的
数目为

(1)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.Cu+基态核外电子排布式为
1s22s22p63s23p63d10
1s22s22p63s23p63d10
.(2)Ca2+的原子结构示意图:


| C | 2- 2 |
| O | 2+ 2 |
| O | 2+ 2 |
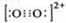
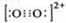
| O | 2+ 2 |
2NA
2NA
.(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是
sp杂化,sp2杂化
sp杂化,sp2杂化
;分子中处于同一直线上的原子数目最多为3
3
.(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中含有的哑铃形
| C | 2- 2 |
| C | 2- 2 |
4
4
.
分析:(1)Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1,根据基态原子的电子排布式书写Cu+的电子排布式;
(2)Ca2+的核电核数为20,原子核外有18个电子,以此书写离子的结构示意图;
的电子式为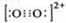 ,由电子式可判断π键数目;
,由电子式可判断π键数目;
(3)H2C=CH-C≡N中,H2C=和=CH-中的C原子都形成3个δ键,以此判断杂化类型;
(4)Ca2+位于晶胞的棱上,注意题中CaC2晶体中含有的哑铃形
的存在,使晶胞沿一个方向拉长.
(2)Ca2+的核电核数为20,原子核外有18个电子,以此书写离子的结构示意图;
| O | 2+ 2 |
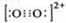 ,由电子式可判断π键数目;
,由电子式可判断π键数目;(3)H2C=CH-C≡N中,H2C=和=CH-中的C原子都形成3个δ键,以此判断杂化类型;
(4)Ca2+位于晶胞的棱上,注意题中CaC2晶体中含有的哑铃形
| C | 2- 2 |
解答:解:(1)Cu为29号元素,Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1,失去2个电子后生成Cu+,Cu+的基本电子排布式为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
(2)Ca2+的核电核数为20,原子核外有18个电子,Ca2+的原子结构示意图为 ,根据等电子体原理可知,O22+的电子式 为
,根据等电子体原理可知,O22+的电子式 为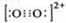 ,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,故答案为:
,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,故答案为: ;
;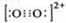 ; 2NA;
; 2NA;
(3)H2C=CH-C≡N中,H2C=和=CH-中的C原子都形成3个δ键,碳原子的杂化轨道类型为sp和sp2杂化,同一直线上有3个原子,故答案为:sp杂化,sp2杂化; 3;
(4)Ca2+位于晶胞的棱上,由于晶胞沿一个方向拉长,1个Ca2+周围距离最近的C22-有4个,而不是6个,故答案为:4.
(2)Ca2+的核电核数为20,原子核外有18个电子,Ca2+的原子结构示意图为
 ,根据等电子体原理可知,O22+的电子式 为
,根据等电子体原理可知,O22+的电子式 为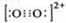 ,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,故答案为:
,在1mol三键含有2mol的π键和1mol的δ键,故1mol O22+中,含有2NA个π键,故答案为: ;
;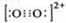 ; 2NA;
; 2NA;(3)H2C=CH-C≡N中,H2C=和=CH-中的C原子都形成3个δ键,碳原子的杂化轨道类型为sp和sp2杂化,同一直线上有3个原子,故答案为:sp杂化,sp2杂化; 3;
(4)Ca2+位于晶胞的棱上,由于晶胞沿一个方向拉长,1个Ca2+周围距离最近的C22-有4个,而不是6个,故答案为:4.
点评:本题主要考查核外电子排布式、等电子体原理、杂化轨道、分子的平面构型、晶体结构等,题目难度中等,注意本题易错点为(4),解答时注意题中所给信息,易错答成6个.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目