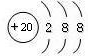
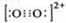题目内容
(2011?江西一模)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
分析:A、阳极PH、溶液体积和离子积计算溶液中的氢氧根离子;
B、硫离子水解;
C、氨水是弱电解质;
D、电解精炼铜阳极减少的不全是铜;
B、硫离子水解;
C、氨水是弱电解质;
D、电解精炼铜阳极减少的不全是铜;
解答:解:A、pH=13的1L Ba(OH)2溶液中,氢氧根离子浓度为0.1mol/L,所以含有OH-数目0.1NA,故A正确;
B、200mL 5mol?L-1Na2S溶液中,硫离子水解含S2-小于NA个,故B错误;
C、氨水是弱电解质,pH=12的1L氨水中含有的NH3?H2O分子数大于0.01 NA,故C错误;
D、电解精炼铜时,阳极失电子的是铜、铁、锌、镍等,若阴极得到电子数为2NA个,阳极质量减少的不全是铜,所以质量不是64g,故D错误;
故选A.
B、200mL 5mol?L-1Na2S溶液中,硫离子水解含S2-小于NA个,故B错误;
C、氨水是弱电解质,pH=12的1L氨水中含有的NH3?H2O分子数大于0.01 NA,故C错误;
D、电解精炼铜时,阳极失电子的是铜、铁、锌、镍等,若阴极得到电子数为2NA个,阳极质量减少的不全是铜,所以质量不是64g,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查溶液中离子物质的量的计算,盐类水解的应用,弱电解质的电离平衡,电解精炼铜的原理应用和计算.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目