题目内容
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下: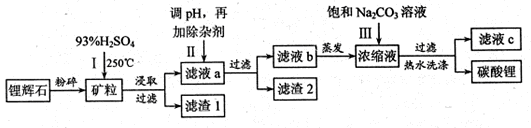
已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
(1)增大锂辉石与硫酸的接触面积,加快浸出反应速率,提高浸出率
(2)Al3+、Fe3+ CaCO3+2H+=Ca2++H2O+CO2↑ (3)2Fe2++H2O2+2H+=2Fe3++2H2O,
(4)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失 (5)Na2SO4
解析试题分析:(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒可以扩大与硫酸的接触面积,加快浸出反应速率,提高浸出率。(2)在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时因为Fe3+、Al3+完全形成氢氧化物沉淀时,溶液的PH分别为3.2、4.7,其它的PH值都大于 6.0—6.5。故此时沉淀的杂质离子有Al3+、Fe3+ 。石灰石调节溶液PH的原理的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。(3)加入双氧水能把亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,其它的反应都是复分解反应。(4)根据表格中碳酸锂的溶解度与温度的关系可知:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。(5)由于它们发生了复分解反应。所以从滤液c中可回收的主要物质是Na2SO4。
考点:考查碳酸锂的制法及应用的知识。

 阅读快车系列答案
阅读快车系列答案TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
回答下列问题:
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)
 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 (4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式: 。
下列关于工业生产的说法中,错误的是( )。
| A.氯碱工业中的阳离子交换膜阻止阳离子通过 |
| B.生产普通玻璃的主要原料有石灰石、石英和纯碱 |
| C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极 |
| D.工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅 |

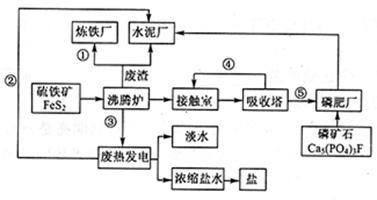

 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。


 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
