题目内容
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为____________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是____________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:
____________________________________________________________ 。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 ![]() Fe + 2ZG
Fe + 2ZG
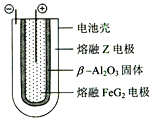
放电时,电池的正极反应式为_______________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为___________________。
【答案】 第二周期VIA HClO4 H2S O3、Cl2、ClO2 2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l);△H=﹣2a kJ · mol-1 ![]()
![]() 2Na+FeCl2==Fe+2NaCl Na β-Al2O3
2Na+FeCl2==Fe+2NaCl Na β-Al2O3
【解析】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,X为主族元素,所以X是H元素;X、Z同主族,可形成离子化合物ZX,Y为主族元素,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体)。
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族;(2)非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4;非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是H2S;(3)Y的单质O3、G的单质Cl2、二者形成的ClO2,均具有强氧化性,可作消毒剂;(4)H2S的燃烧热△H=-a kJmol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-2akJmol-1;(5)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为![]() ;Na与水反应生成氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑;(6)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2
;Na与水反应生成氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑;(6)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2![]() Fe+2NaCl. 放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为Fe2++2e-=Fe;充电时,为电解池,负极发生还原法,故Na电极接电源的负极,由电池结构可知,该电池的电解质为β-Al2O3。
Fe+2NaCl. 放电时为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为Fe2++2e-=Fe;充电时,为电解池,负极发生还原法,故Na电极接电源的负极,由电池结构可知,该电池的电解质为β-Al2O3。

【题目】请按要求回答下列问题:
(1)某同学设计下图装置进行探究“铜和稀硝酸反应制取NO”的实验(夹持装置已略去),则制取NO的化学方程式为:____________;
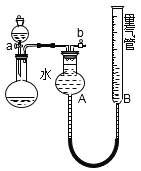
利用该装置还可制取并收集少量其他气体,请完成下表:
制取气体 | 药品 |
O2 | __________ |
_______ | 某溶液_________________、Al |
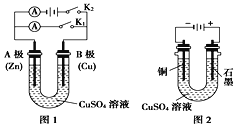
(2)根据图1回答:
①打开K1,合上K2。则此时此装置为 ______;A电极可观察到的现象是____。
(3)根据图2回答:
将纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为_________________。
图2对应的实验完成后,铜电极增重6.4g,石墨电极产生标准状况下的气体体积_____L。