题目内容
【题目】物质A~N存在如图转化关系,其中气体D、E为单质,试回答:
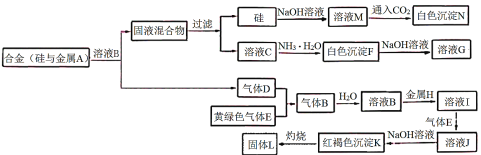
(1)写出下列物质的化学式:
气体B是___,沉淀N是___。
(2)写出反应“C→F”的离子方程式:___。
(3)写出反应“I→J”的离子方程式:___。
(4)在溶液I中直接滴加NaOH溶液,放置中可观察到的现象是___,后期发生变化的原因可用化学方程式解释为___。
(5)固体L是一种红色颜料,将一定量固体L溶于160mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为___g。
【答案】HCl H2SiO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Fe2++Cl2=2Fe3++2Cl- 白色沉淀迅速变为灰绿色,最后变为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 11.2
【解析】
硅和烧碱反应得到M,M是硅酸钠溶液,通入![]() 后变为
后变为![]() 沉淀,N是
沉淀,N是![]() ,溶液C能与氨水反应得到白色沉淀,白色沉淀又能溶于强碱,则C一定是铝盐,F是
,溶液C能与氨水反应得到白色沉淀,白色沉淀又能溶于强碱,则C一定是铝盐,F是![]() ,G则是
,G则是![]() ,A就是铝,铝与溶液B反应得到铝盐和一种单质气体D,D只能是氢气,黄绿色气体E只能是氯气,则氢气和氯气反应得到氯化氢气体B,因此溶液B是盐酸,溶液I虽然不好推断,但是K一定是
,A就是铝,铝与溶液B反应得到铝盐和一种单质气体D,D只能是氢气,黄绿色气体E只能是氯气,则氢气和氯气反应得到氯化氢气体B,因此溶液B是盐酸,溶液I虽然不好推断,但是K一定是![]() 沉淀,则金属H是铁,I是氯化亚铁,J是氯化铁,最后灼烧
沉淀,则金属H是铁,I是氯化亚铁,J是氯化铁,最后灼烧![]() 可以得到铁红
可以得到铁红![]() ,L是
,L是![]() ,本题得解。
,本题得解。
(1)根据分析,B是氢气,N是硅酸;
(2)根据分析,写出铝盐和氨水反应的离子方程式:![]() ;
;
(3)根据分析,写出亚铁被氯气氧化的离子方程式:![]() ;
;
(4)亚铁溶液中加入碱,可以看到白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色沉淀,实际上发生了![]() ;
;
(5)本题最终得到的是![]() 溶液,根据
溶液,根据![]() 先算出
先算出![]() 的物质的量,氯元素是守恒的,因此最后得到的
的物质的量,氯元素是守恒的,因此最后得到的![]() 一共有0.4mol;体系中氧化剂有
一共有0.4mol;体系中氧化剂有![]() 和
和![]() 两种,还原剂只有铁粉,三者最终恰好完全氧化还原,首先根据
两种,还原剂只有铁粉,三者最终恰好完全氧化还原,首先根据![]() 算出
算出![]() (还原产物)的量,则
(还原产物)的量,则![]() 一共得了0.2mol电子,再来看铁,我们可以假设参加反应的铁粉有
一共得了0.2mol电子,再来看铁,我们可以假设参加反应的铁粉有![]() ,则参加反应的
,则参加反应的![]() 有
有![]() ,列出反应中的得失电子守恒:
,列出反应中的得失电子守恒:![]() 解出
解出![]() ,则参加反应的铁粉一共有
,则参加反应的铁粉一共有![]() 。
。

【题目】目前工业上可利用 CO 或 CO2 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三 个化学反应进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是_____(填“吸热”或“放热”)反应;反应③的平衡常数表达式为 K=_____;
(2)根据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_____(用 K1、K2 表示);根据反应③判断ΔS_____(填“>”“=”或“<”)0,在_____(填“较高”或“较低”)温度下有利于该反应自 发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有___________ (填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.从平衡体系中及时分离出 CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时 v(正)__________ v(逆)(填“>”“=”或“<”)。