题目内容
已知常温时反应2Fe3++Cu(1)若固体恰好全部溶解,消耗硫酸的体积为V,则V的取值范围为_________。
(2)若硫酸溶液过量,反应后溶液的体积为1 L,测得溶液中Fe2+浓度为0.1 mol·L-1,则原始混合物中含铜的质量为_________。
(1)0.3 L≤V<0.42 L (2)14.4 g或3.2 g
解析:固体全部溶解,涉及的反应有:
①Fe2O3+3H2SO4![]() Fe2(SO4)3+3H2O
Fe2(SO4)3+3H2O
②Fe2(SO4)3+Cu![]() 2FeSO4+CuSO4
2FeSO4+CuSO4
假设固体只有Fe2O3,反应仅按①进行,显然恰好反应时,应满足:1 mol·L-1×V=3×22.4 g/160 g·mol-1,解得V=0.42 L。
假设固体是Cu和Fe2O3的混合物,反应按①②两式进行,若要固体恰好溶解,物质的量应满足:n(Cu)=n〔Fe2(SO4)3〕=n(Fe2O3)=x mol,依题意:64x+160x=22.4,解得x=0.1
由反应①得关系式1 mol·L-1×V=3×0.1 mol,V=0.3 L。
所以V的取值范围是:0.3 L≤V<0.42 L
(2)溶液中,n(Fe2+)=0.1 mol,它是由反应式②生成的,因为Fe2(SO4)3和Cu谁过量,题目中不明确,故需要加以讨论。
若Cu过量,是n(Fe2O3)=n〔Fe2(SO4)3〕=1/2n(Fe2SO4)=0.05 mol,Cu的质量为:22.4 g-m(Fe2O3)=22.4 g-0.05 mol×160 g·mol-1=14.4 g
若Fe2(SO4)3过量,则n(Cu)=1/2n(FeSO4)=0.05 mol,Cu的质量为0.05 mol×64 g·mol-1=3.2 g
综上讨论,原混合物中铜的质量为14.4 g或3.2 g。

硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下: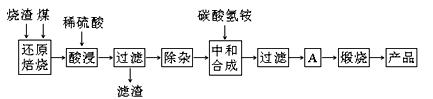
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。