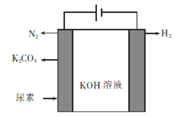
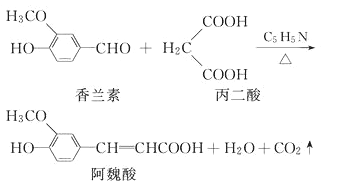
题目内容
【题目】某同学查阅资料获悉:用KMnO4可以测定H2O2的物质的量浓度:取15.00mL H2O2溶液,用稀H2SO4酸化;逐滴加入0.003mol·L-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至恰好完全反应时共消耗20.00 mL KMnO4溶液。该反应的离子方程式是:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
(1)该反应体现了H2O2的__________(填“氧化性”、“还原性”或“氧化性和还原性”);
(2)KMnO4溶液褪色速率开始较慢,后变快的原因可能是某种物质对该反应起到了催化作用,则该物质最有可能是________;(填序号) a. MnO4- b.H+ c.Mn2+ d.K+
(3)判断完全反应的现象是_________________________________________________;
(4)该H2O2溶液的物质的量浓度是__________________。
【答案】 还原性 c 当加入最后一滴KMnO4溶液时,溶液变为红色 0.01 mol·L-1
【解析】(1)H2O2中O元素的化合价从-1价升高到了O2中O元素的0价,所以H2O2作还原剂,体现了还原性。
(2)由离子方程式可知,反应后生成了Mn2+,开始Mn2+浓度较小,反应速率慢,反应一段时间后,Mn2+浓度变大,反应速率加快,故起催化作用的物质是Mn2+
(3)KMnO4溶液显紫色,当KMnO4溶液与H2O2发生氧化还原反应时,溶液无色,当H2O2完全反应后,再滴入一滴KMnO4溶液,溶液将由无色变为红色,此时就是滴定的终点。故答案为:当加入最后一滴KMnO4溶液时,溶液变为红色 。
(4)消耗的KMnO4的物质的量为0.02L×0.003mol·L-1=6×10-5mol,根据方程式可知H2O2的物质的量为![]() ×6×10-5mol=1.5×10-4mol,所以H2O2溶液的物质的量浓度c=1.5×10-4mol÷0.015L = 0.01 mol·L-1
×6×10-5mol=1.5×10-4mol,所以H2O2溶液的物质的量浓度c=1.5×10-4mol÷0.015L = 0.01 mol·L-1

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】A、B、C、D、E均为短周期元素,非金属元素A的最外层电子数与其周期数相等,B的成对电子与未成对电子所占据的原子轨道数相等。单质B在单质C中充分燃烧生成BC2。 D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水会得到一种强酸。
(1)B在元素周期表中的位置是________,写出一种工业制备单质E的化学方程式:_____。
(2)B、C、D组成的一种盐中,B的质量分数为17. 91%,D的质量分数为34. 3 3%。该盐的化学式为________,其阴离子中B原子的杂化方式为__________。
(3)由这些元素组成的某些物质的组成和结构信息如下表:
物质 | 组成和结构 |
a | A、D两元素组成的离子化合物 |
b | 由C、D两元素组成的含有非极性键的离子化合物 |
c | 化学组成为BCE2 |
a的电子式为_________;b的化学式为________;c的空间构型为___________。