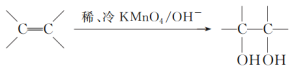题目内容
【题目】原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
(1)B2A2是有机合成工业的一种原料. (i)将B2A2通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀.[Cu(NH3)2]Cl中存在的化学键的类型有 , Cu+基态核外电子排布式为 .
(ii)B2A2与ABC反应可得丙烯腈(H2C=CH﹣C≡N).ABC分子的构型是 . 丙烯腈分子中碳原子轨道杂化类型是
(2)工业上用EB2与A2D反应生成B2A2 . (i)EB2中的B22﹣与D22+互为等电子体,D22+的电子式可表示为;1mol D22+中含有的π键数目为 .
(ii)工业制B2A2的原料(EB2、A2D)以及产物(B2A2)的沸点从高到低排序,其顺序为(用化学式表示),其理由为 .
(iii)EB2晶体的晶胞结构与NaCl晶体的相似(如图所示),但EB2晶体中含有的中哑铃形B22﹣的存在,使晶胞沿一个方向拉长,晶胞的边长分别为0.387nm、0.387nm、0.637nm.EB2晶体中,阳离子的配位数为 , 距离最近的两个阳离子之间的距离为nm(保留3位有效数字),EB2的密度g/cm3(列式即可).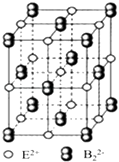
【答案】
(1)离子键、共价键和配位键;1s22s22p63s23p63d10或[Ar]3d10;直线形;sp和sp2
(2)![]() ;2NA;CaC2H2OC2H2;CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2;4;0.273;
;2NA;CaC2H2OC2H2;CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2;4;0.273;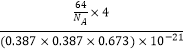
【解析】解:原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,则A是H、D是O元素,甲是H2O、乙是H2O2;B是形成化合物种类最多的元素,为C元素;
C原子基态时2p原子轨道上有3个未成对的电子,则C是N元素;
E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同,则E是Ca元素;
·(1)(i)阴阳离子之间存在离子键,非金属元素之间易形成共价键,含有孤电子对和空轨道的原子之间易形成配位键,所以铜铵络离子和氯离子之间存在离子键、N﹣H原子之间存在共价键、Cu原子和N原子之间存在配位键,所以该物质中含有离子键、共价键和配位键;
Cu是29号元素,其原子核外有29个电子,Cu原子失去最外层1个电子生成Cu+ , 根据构造原理书写Cu+核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 ,
所以答案是:离子键、共价键和配位键;1s22s22p63s23p63d10或[Ar]3d10;
(ii)C2H2与HCN反应可得丙烯腈(H2C=CH﹣C≡N),HCN分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论知,HCN分子的构型为直线形,丙烯腈分子中亚甲基C原子价层电子对个数是3、剩余两个C原子价层电子对个数是2,根据价层电子对互斥理论判断C原子杂化类型为sp和sp2 ,
所以答案是:直线形;sp和sp2;
·(2)(i)CaC2中的C22﹣与O22+互为等电子体,等电子体原子个数相同、电子数相同、结构相似,据此书写O22+的电子式为 ![]() ;一个O22+中含有2个π键,则1mol该离子含有2NA个π键,
;一个O22+中含有2个π键,则1mol该离子含有2NA个π键,
所以答案是: ![]() ;2NA;
;2NA;
(ii)工业制C2H2的原料(CaC2、H2O)以及产物(C2H2)的沸点从高到低排序,离子晶体熔沸点高于分子晶体,含有氢键的熔沸点较高,水中含有氢键而乙炔中不含氢键,则熔沸点大小顺序是CaC2 H2O C2H2 ,
所以答案是:CaC2 H2O C2H2;CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2;
(iii)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22﹣的存在,使晶胞沿一个方向拉长,晶胞的边长分别为0.387nm、0.387nm、0.637nm,CaC2晶体中,阳离子的配位数为4,距离最近的两个阳离子之间的距离= ![]() ×
× ![]() nm=0.273nm;
nm=0.273nm;
该晶胞中Ca2+个数=12× ![]() +1=4、C22﹣个数=8×
+1=4、C22﹣个数=8× ![]() +8×
+8× ![]() =4,其密度=
=4,其密度= ![]() =
= 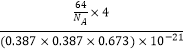 g/cm3 ,
g/cm3 ,
所以答案是:4;0.273; 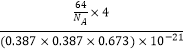 .
.

 字词句段篇系列答案
字词句段篇系列答案