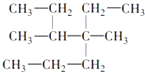��Ŀ����
����Ŀ��2014��ŵ��������ѧ�������Ĺ����Ƿ�����һ�ָ�Ч�������Ĺ�Դ������ɫ��������ܣ�LED����ijͬѧ�Դ˷dz�����Ȥ���������ijͬѧ��������ռ��Ĺ�����
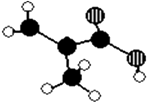
��1��LED�о���ʼ�ڶ�̼���辧����о���1907�꣬Ӣ����ѧ��Henry Joseph Round������ʩ�ӵ���ʱ�ܹ���̼���辧���з��ַ������� ��i��̼���辧���������壮
��ii��̼����ľ����ṹ����ʯ�����ƣ���̼���辧���У�̼ԭ����������С�Ļ�����̼ԭ�Ӻ�����ԭ����ɣ�ÿ��̼ԭ�������������Ļ���
��iii��̼�����У�̼ԭ�Ӳ�ȡ�ӻ���ʽ������Χ�Ĺ�ԭ���γɵļ���Ϊ ��
��iv������ԭ�ӽṹ��֪ʶ���ͷ����ԭ�� ��
��2���ִ�LED��1962�꣬GE��˾ʹ�����黯�أ�GaAsxP1��x�������Ƴ��˺�ɫ��������ܣ����ǵ�һ�ſɼ���LED������Ϊ�ִ�LED֮�森����ֳ�������ɫLED���أ�GaP���ͻ�ɫLED̼���裬ʹ������չ���ȹ⡢�ƹ���̹⣮ ��i������Ԫ�����ڱ���λ���� �� ���̬ԭ�ӵļ۵����Ų�ʽΪ ��
��ii�����Ƿ��������黯�ػ������в��ӵ������õ����������λ�ã�����������䷢��Ч�ʣ���ԭ����Ϊ����ѡ����
A�����İ뾶������İ뾶С���õ����沿�������λ�ò���Ӱ�쾧��Ĺ��ͣ�
B��N�ĵ�һ�����ܴ������飬����ʧȥ���ӣ���������ԾǨ��
C��N�ĵ縺�Դ��Ӻ�õ���λ���д��������
D��N�����顢������ͬ�۵��ӽṹ�����ʣ����Ե�����������������ǿ����ɵȵ������壮
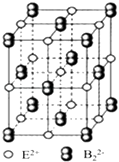
��3��1993�꣬�д������˿���������������ĵ�����LED��ƾ��˳ɾͣ��������2014��ŵ��������ѧ���� Ϊ���Ե�������ɫLED��ǿ������Ĺ�ϵ���õ���ͼ����ͼ�����ܵõ�������дһ�����ɣ�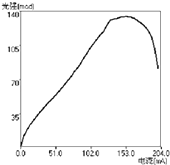
���𰸡�
��1��ԭ�ӣ�3��3��12��sp3��![]() �����Ӵ������ϸߵĹ��ԾǨ�������ϵ͵Ĺ��ʱ���Թ����ʽ�ͷ�����
�����Ӵ������ϸߵĹ��ԾǨ�������ϵ͵Ĺ��ʱ���Թ����ʽ�ͷ�����
��2���������ڢ�A�壻4s24p1��BC
��3������������ͬʱ��������С��153.0 mAʱ����������ɫLED��ǿ���ŵ��������Ӷ���ǿ������������153.0 mAʱ����ǿ���ŵ�������ǿ������
���������⣺��1����i��̼���辧������ԭ�Ӿ��壬���Դ��ǣ�ԭ�ӣ���ii�����ʯ�����У�̼ԭ����������С�Ļ�����6��̼ԭ�ӣ�̼���辧������С�Ļ�����6��ԭ�ӣ���C��Siԭ����Ŀ֮��Ϊ1��1������̼���辧���У�̼ԭ����������С�Ļ���3��̼ԭ�Ӻ�3����ԭ����ɣ�ÿ��Cԭ���γ�4��C��Si��������2��C��Si����2����Ԫ����4��C��Si����6����ϣ�����ÿ��̼ԭ������2��6=12 �������Ļ������Դ��ǣ�3��3��12����iii��̼�����У�̼ԭ���γ�4��C��Si�����ӻ������ĿΪ4��Cԭ�Ӳ�ȡsp3�ӻ���Cԭ������Χ��4��Siԭ���γ���������ṹ������Ϊ��109��28����
���Դ��ǣ�sp3��109��28������iv�����Ӵ������ϸߵĹ��ԾǨ�������ϵ͵Ĺ��ʱ���Թ����ʽ�ͷ�������
���Դ��ǣ����Ӵ������ϸߵĹ��ԾǨ�������ϵ͵Ĺ��ʱ���Թ����ʽ�ͷ���������2����i������Ԫ�����ڱ���λ���ǣ��������ڢ�A�壬���̬ԭ�ӵļ۵����Ų�ʽΪ4s24p1 ��
���Դ��ǣ��������ڢ�A�壻4s24p1����ii��A�����İ뾶������İ뾶С���õ����沿�������λ�ò���Ӱ�쾧��Ĺ��ͣ�������ȷ��
B��N�ĵ�һ�����ܴ������飬������ʧȥ���ӣ��ʲ�������ȷ��
C�����黯�ػ�������û��Hԭ�ӣ�����Nԭ�Ӳ����γ��������������ȷ��
N�ĵ縺�Դ��Ӻ�õ���λ���д��������
D��N�����顢������ͬ�۵��ӽṹ�����ʣ�N�����縺�Խϴ��Ե�����������������ǿ����ɵȵ������壬������ȷ��
��ѡ��BC����3����ͼ��֪������������ͬʱ��������С��153.0 mAʱ����������ɫLED��ǿ���ŵ��������Ӷ���ǿ������������153.0 mAʱ����ǿ���ŵ�������ǿ��������
���Դ��ǣ�����������ͬʱ��������С��153.0 mAʱ����������ɫLED��ǿ���ŵ��������Ӷ���ǿ������������153.0 mAʱ����ǿ���ŵ�������ǿ��������
�����㾫����������Ĺؼ���������ԭ�Ӿ�������֪ʶ����������ԭ�Ӽ��Թ��ۼ����϶��γɿռ���״�ṹ�ľ����ԭ�Ӿ��壮

 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�