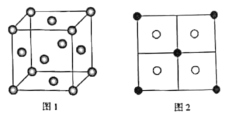
题目内容
【题目】溶于海水的CO2主要以4种无机碳形式存在,其中 HCO3-占95 % ,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是
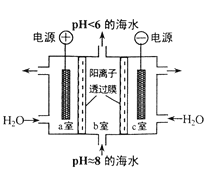
A. a 室排出的是NaOH 、Ca(OH)2等强碱性物质
B. 装置中产生的 O2和提取的 CO2的体积比约为1:4
C. c室发生的反应为 2H2O-4e-===O2↑+ 4H+
D. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
【答案】B
【解析】
a室电极与电源正极相连,是电解池阳极,电极反应为2H2O4e=O2↑+4H+。H+通过阳离子交换膜进入c室;c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e=H2↑+2OH。b室海水中阳离子通过离子交换膜进入c室,故c室排出的是NaOH、Ca(OH)2等强碱性物质。
A.根据上述分析,c 室排出的是NaOH 、Ca(OH)2等强碱性物质,故A错误;
B. 由电极反应为2H2O4e=O2↑+4H+可知,标况下产生1mol O2,同时产生4mol H+,4mol H+与4mol HCO3-反应,产生4mol CO2,相同条件下,物质的量之比等于体积之比,因此产生的 O2和提取的 CO2的体积比约为1:4,故B正确;
C. c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e=H2↑+2OH,故C错误;
D. 电路中每有0.2mol电子通过时,就有0.2mol阳离子从a室移至b室,故D错误;
答案选B。

【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1