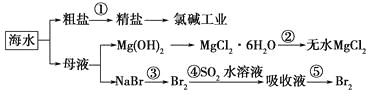
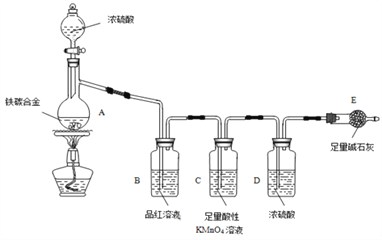
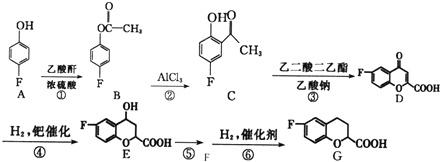
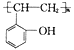
题目内容
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上的电子数是原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
Z | 元素最高正价是+7价 |
完成下列问题:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(2)元素Y与氢元素形成一种分子YH3,写出该粒子的电子式________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(4)T、X、Z三种元素最高价氧化物的水化物酸性由强到弱的顺序是_____(用化学式表示)。
【答案】 146C ![]() Cl b HClO4>H2SO4>H2CO3
Cl b HClO4>H2SO4>H2CO3
【解析】试题分析:T元素M层上的电子数是原子核外电子层数的2倍,T是S元素;X元素最外层电子数是次外层电子数的2倍,X是C元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,Y是N元素;Z元素最高正价是+7价,Z是Cl元素。
解析:根据以上分析,(1)C的一种同位素可测定文物年代,这种同位素的符号是![]() 。(2)N元素与氢元素形成一种分子是NH3,NH3的电子式是
。(2)N元素与氢元素形成一种分子是NH3,NH3的电子式是![]() 。(3)同周期元素从左到右非金属性增强,元素Cl与元素S相比,非金属性较强的是Cl; a.单质的状态不能判断非金属性,故a错误; b.非金属性越强气态氢化物越稳定,HCl比H2S稳定,故b正确; c.与NaOH溶液反应不能比较非金属性强弱,故c错误。
。(3)同周期元素从左到右非金属性增强,元素Cl与元素S相比,非金属性较强的是Cl; a.单质的状态不能判断非金属性,故a错误; b.非金属性越强气态氢化物越稳定,HCl比H2S稳定,故b正确; c.与NaOH溶液反应不能比较非金属性强弱,故c错误。
(4)非金属性越强,最高价氧化物的水化物酸性越强;非金属性C<S<Cl,三种元素最高价氧化物的水化物酸性由强到弱的顺序是HClO4>H2SO4>H2CO3。

【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
【题目】利用下列装置可以完成的实验组合是

选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
【题目】请回答下列问题:
(1)①Fe原子的核外电子排布式为[Ar]_________,Mg原子核外占据最高能层电子的电子云轮廓图形状为_________。
②As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为

以下关于维生素B1的说法正确的是________。
A.只含σ键和π键
B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl
D.该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间作用力有________。
A.离子键、共价键 B.离子键、氢键、共价键
C.氢键、范德华力 D.离子键、氢键、范德华力