题目内容
【题目】下列反应一定不能自发的是( )
A.2KClO3(s)═2KCl(s)+3O2(g)△H=﹣78.03kJmol﹣1 △S=+1110 Jmol﹣1K﹣1
B.CO(g)═C(s,石墨)+ ![]() O2(g)△H=+110.5kJmol﹣1△S=﹣89.36 Jmol﹣1K﹣1
O2(g)△H=+110.5kJmol﹣1△S=﹣89.36 Jmol﹣1K﹣1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=﹣444.3kJmol﹣1△S=﹣280.1 J.mol﹣1K﹣1
D.NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l)△H=+37.301kJmol﹣1△S=+184.05 Jmol﹣1K﹣1
【答案】B
【解析】解:A.△H=﹣78.03kJmol﹣1 △S=+1110 Jmol﹣1K﹣1,任何温度下△H﹣T△S<0,反应可自发进行,故A不选;
B.△H=+110.5kJmol﹣1 △S=﹣89.36 Jmol﹣1K﹣1,△H﹣T△S>0,一定不能自发进行,故B选;
C.△H=﹣444.3kJmol﹣1 △S=﹣280.1 J.mol﹣1K﹣1,低温下△H﹣T△S<0,反应可自发进行,故C不选;
D.△H=+37.301kJmol﹣1 △S=+184.05 Jmol﹣1K﹣1,高温下△H﹣T△S<0,反应可自发进行,故D不选;
故选B.
【考点精析】根据题目的已知条件,利用反应热和焓变的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。
)。
反应如下: +ClC(CH3)3
+ClC(CH3)3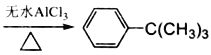 +HCl
+HCl
已知下列信息:
物质 | 相对分子质量 | 密度 | 熔点 | 沸点 | 溶解性 |
AlCl3 | —— | —— | 190℃ | 180℃ | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88g/cm3 | —— | 80.1℃ | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.84 g/cm3 | —— | 51.6℃ | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 g/cm3 | —— | 169℃ | 难溶于水,易溶于苯 |
I、如下图是实验室制备无水AlCl3的实验装置:
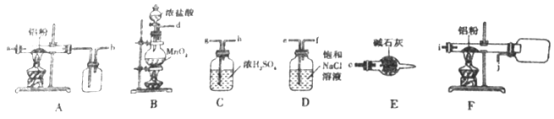
(1)E装置中的仪器名称是_______________。
(2)写出B装置中发生反应的离子方程式:________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________ (写导管口标号)。
(4)下列操作正确的是________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:_______________________。
p>II、实验室制取叔丁基苯装置如图: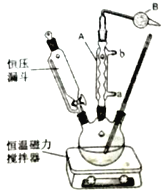
在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是___________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是_____________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为______。(保留3位有效数字)
【答案】 干燥管 MnO2+4H++2C1-=Mn2++Cl2↑+2H2O d、e、f、g、h、i、j、c 乙 防止空气中的水蒸气进入,还吸收多余的氯气 使液体顺利滴下 干燥 ②①③ 75.0%
【解析】I.(1). E装置中的仪器名称是干燥管,故答案为:干燥管;
(2). 在B装置中,浓盐酸和MnO2反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl=Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl=Mn2++Cl2↑+2H2O;
(3). B装置产生的氯气中混有氯化氢和水蒸气杂质,用D装置除去HCl 杂质,C装置除去水蒸气杂质,由于氯化铝易升华,产生的氯化铝颗粒易堵塞导气管,所以得到纯净的氯气后在F装置中和铝反应制取氯化铝而不用A装置,根据信息可知氯化铝遇水极易潮解并产生白色烟雾,所以最后必须用E装置吸收多余的氯气并可以防止空气中的水蒸气进入F装置中,因此制备无水氯化铝正确的连接顺序为d、e、f、g、h、i、j、c,故答案为:d、e、f、g、h、i、j、c;
(4). 制备无水氯化铝时,应先加热圆底烧瓶产生氯气,将装置中的空气排尽,以防止铝粉被空气中的氧气氧化,故答案为:乙;
(5). 由上述分析可知,用E装置可以吸收多余的氯气并能防止空气中的水蒸气进入F装置中使氯化铝潮解,故答案为:防止空气中的水蒸气进入,还吸收多余的氯气;
II. (6). 使用恒压漏斗可以平衡漏斗内外压强,使液体顺利滴下,在洗涤后所得产物中加入少量无水MgSO4固体,目的是吸收产品中少量的水分,起到干燥的作用,故答案为:使液体顺利滴下;干燥;
(7). 稀盐酸洗涤可以除去氯化铝杂质,再用5%Na2CO3溶液除去过量的盐酸,最后用水洗涤除去剩余的5%Na2CO3,故答案为:②①③;
(8).加入苯的物质的量为50mL×0.88g/mL÷78g/mol=0.56mol,氯代叔丁烷的物质的量为10mL×1.84g/mL÷92.5g/mol=0.199mol,由反应方程式 +ClC(CH3)3
+ClC(CH3)3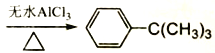 +HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:
+HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:![]() ×100%=75.0%,故答案为:75.0%。
×100%=75.0%,故答案为:75.0%。
【题型】实验题
【结束】
9
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面:锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)从废料中回收氧化钴(CoO)的工艺流程如下:
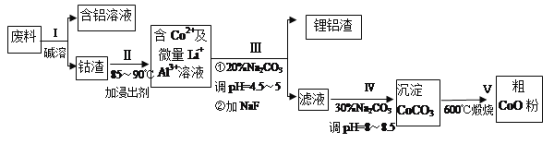
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是____________。
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为_________________。
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根) _______________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________________________________。
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式__________________________________。
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________,Co2+是否沉淀完全? __________(填“是”或“否”)。
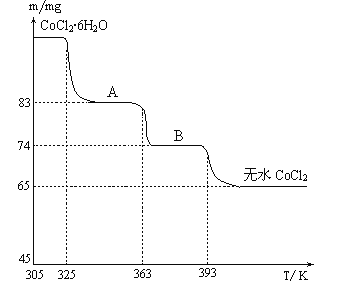
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是____________________。