题目内容
【题目】把18.0mol/L的浓硫酸稀释成1.8mol/L的稀硫酸100ml,实验操作如下:
(1)A. 将配好的稀硫酸倒入试剂瓶中,贴好标签;
B. 盖好容量瓶塞,反复颠倒,摇匀;
C. 用量筒取mL的18.0mol/L的浓硫酸;
D. 将沿烧杯内壁慢慢注入盛有少量的烧杯中;
E. 用少量蒸馏水洗涤烧杯2﹣3次,并将洗涤液也全部转移到容量瓶中;
F. 将已冷却至室温的硫酸溶液沿玻璃棒注入100mL的容量瓶中;
G. 改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H. 继续向容量瓶加蒸馏水,直到液面接近刻度线cm处.
填写上述步骤中的空白;
(2)请按正确的操作步骤进行排序 .
(3)试分析下列操作会使所配溶液的浓度会大于1.80mol/L浓度
A.用量筒取浓硫酸时,为了精确,用水洗涤量筒,并将洗涤液倒入烧杯中.
B.溶解后,立刻移液.
C.若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线.
D.若定容时仰视看刻度线,会使稀硫酸溶液的浓度.
E.若摇匀后发现液面低于刻度线,又加水至刻度线.
(4)取20ml配好的硫酸,和足量的铝反应后,可收集到标准状况下的H2ml.
【答案】
(1)10.0;浓硫酸;水;1﹣2
(2)C D F E H G B A
(3)AB
(4)806.4
【解析】解:(1)C、设需要的浓硫酸的体积为VmL,根据溶液的稀释定律C浓V浓=C稀V稀可知:
18mol/L×VmL=1.8mol/L×100mL
解得V=10.0mL,所以答案是:10.0;
D、由于浓硫酸的稀释放热,故要将浓硫酸沿烧杯内壁注入水中,所以答案是:浓硫酸,水;
H、定容时,要先直接向容量瓶中加水,至液面离刻度线1﹣2cm时,改用胶头滴管逐滴加入,所以答案是:1﹣2;(2)根据操作过程是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶等步骤来排序可知:正确的操作顺序是:C D F E H G B A,所以答案是:C D F E H G B A;(3)A.用量筒取浓硫酸后用水洗涤量筒,并将洗涤液倒入烧杯中,会导致浓硫酸的量偏多,则浓度偏高,故A正确.
B.溶解后,立刻移液,则冷却后溶液体积偏小,则浓度偏高,故B正确.
C.若加蒸馏水超过了刻度线,倒出一些溶液,则倒出的不止是水,还有溶质,故再重新加蒸馏水到刻度线,则浓度偏小,故C错误;
D.若定容时仰视看刻度线,则溶液体积偏大,则会使稀硫酸溶液的浓度偏小,故D错误.
E.摇匀后发现液面低于刻度线是正常的,又加水至刻度线,则浓度偏小,故E错误.
故选AB.(4)20mL溶液中硫酸的物质的量n=CV=1.8mol/L×0.02L=0.036mol,设生成的氢气的物质的量为xmol,根据1molH2SO4~1molH2可知:
H2SO4 | ~ | 1molH2 |
1 | 1 | |
0.036mol | xmol |
故有: ![]()
解得x=0.036mol
在标况下的体积V=nVm=0.036mol×22.4L/mol=806.4mL
所以答案是:806.4.
【考点精析】通过灵活运用配制一定物质的量浓度的溶液,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线即可以解答此题.

 期末冲刺100分创新金卷完全试卷系列答案
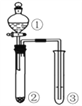
期末冲刺100分创新金卷完全试卷系列答案【题目】利用右图所示装置进行下列实验,能得到相应实验结论的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Na2SO3 | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2 >Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A. A B. B C. C D. D