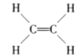
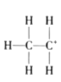
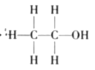
题目内容
【题目】对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是( )

A.步骤①所加试剂可以是浓KOH溶液
B.可以用湿润的蓝色石蕊试纸检验生成的无色气体
C.步骤②的反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.检验Fe3+的离子反应方程式为Fe3++3SCN-=Fe(SCN)3↓(血红色)
【答案】A
【解析】
溶液中加入物质后产生红褐色的沉淀同时产生气体,所加入的物质是碱,铵根离子和碱反应得到氨气,铁离子和碱反应得到的是氢氧化铁沉淀,溶液X是偏铝酸盐的溶液,偏铝酸根和碳酸氢根离子之间反应可以得到氢氧化铝沉淀。
A. 根据以上分析,步骤①所加试剂可以是浓KOH 溶液或是其他强碱溶液,A正确;
B. 可以用湿润的红色石蕊试纸检验生成的无色气体氨气,会变蓝,B错误;
C. 步骤②反应H2O+AlO2-+HCO3-= Al(OH)3↓+CO32-,C错误;
D. Fe3+与SCN-反应产生Fe(SCN)3是可溶性弱电解质,使溶液变为血红色,但不是血红色沉淀,D错误;
答案选A。

【题目】含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)CO2(g)+H2(g) ΔH=__kJ·mol1。
下列有利于提高CO平衡转化率的措施有__(填标号)。
a.增大压强 b.降低温度 c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KOH溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为__,若电解过程中转移1mol电子,阳极生成气体的体积(标准状况)为__L。
(3)乙苯催化脱氢制取苯乙烯的反应为:
![]() (g)+CO2(g)
(g)+CO2(g)![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:

①一定温度下,向恒容密闭容器中充入2mol乙苯和2molCO2,起始压强为p0,平衡时容器内气体总物质的量为5mol,乙苯的转化率为__,用平衡分压代替平衡浓度表示的化学平衡常数Kp=__。[气体分压(p分)=气体总压(p总)×气体体积分数]
②乙苯平衡转化率与p(CO2)的关系如图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因__。