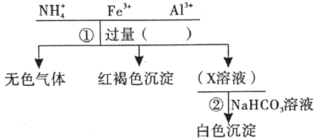
题目内容
【题目】某微粒A的结构示意图为![]()
(1)若A是原子,则A的元素符号为__;若A是带一个正电荷的阳离子,则X=___
(2)若X=8,则此阴离子与(1)中带一个正电荷的阳离子形成一种常见化合物的化学式是___,它是不是电解质(填是或否)____。写出此化合物与盐酸反应的化学方程式:________________________________
(3)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:___(填序号)
①CH4 ②H2O2 ③HF ④Al3+ ⑤Cl- ⑥NH4+
(4)若A的阳离子为An+且质量数为a,则其质子数为____________,中子数为_______________(用含有a,n的代数式表达)
【答案】![]() 11 Na2O 是 Na2O+2HCl=2NaCl+H2O ①③④⑥
11 Na2O 是 Na2O+2HCl=2NaCl+H2O ①③④⑥ ![]()
![]()
【解析】
(1)在原子中,核内质子数=核外电子数;阳离子,质子数=核外电子数+所带电荷数;
(2)当x=8时,核内质子数小于核外电子数,该粒子是氧离子,与钠离子形成一种常见化合物的化学式是Na2O;
(3)甲烷、氟化氢分子含有10个电子,铝离子、铵根离子含有10个电子;
(4)阳离子,质子数=核外电子数+所带电荷数,中子数=质量数-质子数。
(1)在原子中,核内质子数=核外电子数,当x=10时,该微粒是Ne原子;若A是带一个正电荷的阳离子,则核内质子数比核外电子数多1,即为11;
(2)当x=8时,核内质子数小于核外电子数,该粒子是氧离子,与钠离子形成一种常见化合物的化学式是Na2O,属于电解质,与盐酸反应的方程式为:Na2O+2HCl=2NaCl+H2O;
(3)甲烷、氟化氢分子含有10个电子,铝离子、铵根离子含有10个电子;
故答案为:①③④⑥;
(4)A的阳离子为An+且质量数为a,则其质子数为10+n,中子数为质量数-质子数=a-(10+n)。

【题目】参考下列图表和有关要求回答问题:
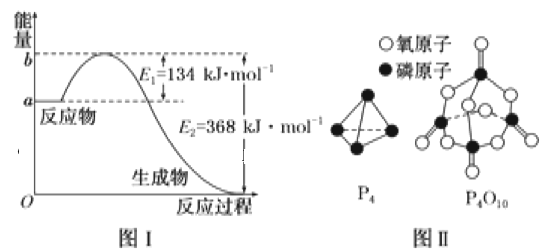
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是__(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=__kJ·mol-1。
(3)PCl5是一种重要的含磷化合物,在有机合成中用作氯化剂。某温度时,向2.0L恒温恒容密闭容器中充入1.0molPCl5,发生反应PCl5(g)![]() PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
反应在前50s的平均速率v(PCl5)=__。在该温度下,若起始时充入0.5molPCl5和amolCl2,平衡时PCl5的转化率仍为20%,则a=__。